碘化氰
碘化氰是一种无机化合物,化学式为ICN。这是由拟卤素氰和碘形成的化合物。它是有毒的白色挥发性晶体,与水缓慢反应生成氰化氢。[4][5][6]它于1824年由法国化学家Georges-Simon Serullas首次制备。[7]
| 碘化氰 | |
|---|---|
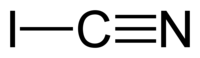 | |
 | |
 | |
| IUPAC名 Carbononitridic iodide[1] | |
| 别名 | 氰化碘[2];碘甲腈 |
| 识别 | |
| CAS号 | 506-78-5 |
| PubChem | 10478 |
| ChemSpider | 10046 |
| SMILES |
|
| InChI |
|
| InChIKey | WPBXOELOQKLBDF-UHFFFAOYAT |
| EINECS | 208-053-3 |
| RTECS | NN1750000 |
| 性质[3] | |
| 化学式 | ICN |
| 152.9219 g·mol⁻¹ | |
| 外观 | 白色晶体 |
| 密度 | 1.84 g/cm3 |
| 熔点 | 146.7 °C |
| 溶解性(水) | 可溶并缓慢反应 |
| 溶解性 | 可溶于乙醇、乙醚 |
| 危险性 | |
| NFPA 704 |
 0
3
0
|
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
反应
在酸催化下,碘化氰会自发聚合。[8]碘化氰在150 °C(423 K)下分解成碘和氰。[9]它和过量的硝酸氯在−70 °C(203 K)下反应,生成[ICN]2+([NO3]-)2。[10]在溶液中,碘化氰能和氰离子反应,生成[I(CN)2]-离子。[10]
危害
碘化氰在吸入或摄入时有毒,如果通过皮肤吞咽或吸收,可能会致命。 碘化氰可能导致抽搐、瘫痪和呼吸衰竭而死亡。碘化氰是一种强烈的刺激物,如果接触,可能会对眼睛和皮肤造成灼伤。 如果加热碘化氰至分解,它会释放有毒的氮氧化物,氰化物和碘化物气体。碘化氰还会和酸、碱、胺和醇。碘化氰会和水或二氧化碳反应,形成氢氰酸。[11][13][14][15]
外部链接
参考资料
- . PubChem Compound. USA: National Center for Biotechnology Information. Identification. 2005-03-27 [2012-06-04]. (原始内容存档于2014-01-04).
-
 10th. Rahway, NJ: Merck & Co. 1983: 385.
10th. Rahway, NJ: Merck & Co. 1983: 385. - Lide, David R. (编), 87th, Boca Raton, FL: CRC Press, 2006, ISBN 0-8493-0487-3
- Bak, B. (1952). "CYANOGEN IODIDE". Org. Synth. 32: 29; Coll. Vol. 4: 207.
- Langlois, M. . Comptes Rendus. 1860, 51: 29 [2011-05-27]. (原始内容存档于2016-02-08).
- Langlois, M. . Annalen der Chemie und Pharmacie. 1860, 116 (3): 288. doi:10.1002/jlac.18601160303.
- Serullas. [New compound of iodine, nitrogen, and carbon, or cyanide of iodine]. Annales de Chimie et de Physique. 2nd series. 1824, 27: 184–195 (法语).
- hrsg. von Georg Brauer. Unter Mitarb. von M. Baudler. . Stuttgart: Enke. 1975: 634. ISBN 3-432-02328-6. OCLC 310719485 (德语).
- Gail, Ernst; Gos, Stephen; Kulzer, Rupprecht; Lorösch, Jürgen; Rubo, Andreas; Sauer, Manfred; Kellens, Raf; Reddy, Jay; Steier, Norbert; Hasenpusch, Wolfgang, , Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, 2011-10-15, doi:10.1002/14356007.a08_159.pub3
- Schulz, Axel; Surkau, Jonas. . Reviews in Inorganic Chemistry (Walter de Gruyter GmbH). 2022-09-21, 43 (1): 49–188. ISSN 0193-4929. doi:10.1515/revic-2021-0044.
- Pohanish, R. P. . 6th. Elsevier. 2011: 808 [2021-03-10]. ISBN 978-1-4377-7869-4. (原始内容存档于2017-04-17).
- . . Encyclopædia Britannica Inc. 2012 [2012-04-12]. (原始内容存档于2012-01-02).
- . PubChem. NIH. [2021-03-10]. (原始内容存档于2014-01-04).
- . National Institute for Occupational Safety and Health, Centers for Disease Control and Prevention. 2005 [2012-04-12]. (原始内容存档于2018-04-06).
- . ChemicalBook. [2021-03-10]. (原始内容存档于2018-08-09).
延伸阅读
- Langlois M. . Comp Rendus. 1860, 51: 29 [2011-05-27]. (原始内容存档于2016-02-08).
- Langlois M. . Annalen der Chemie und Pharmacie. 1860, 116 (3): 288. doi:10.1002/jlac.18601160303.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.