科里-富克斯反应
科里-富克斯反应,又称拉米雷斯-科里-富克斯反应,指醛与四溴化碳和三苯基膦反应,发生一碳同系化生成二溴烯烃,然后再用正丁基锂处理而得到末端炔烃。[1][2][3]
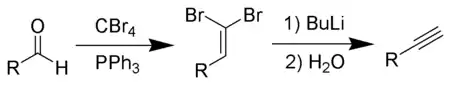
科里-富克斯反应
反应由美国化学家艾里亚斯·詹姆斯·科里和菲利普·L·富克斯的名字命名。与早期Desai等[4]制取二溴烯烃的方法相比,锌粉的加入促进了叶立德中间体的生成,从而减少了三苯基膦的用量,分离更易,产率更高。对于敏感的底物,需用三乙胺代替锌才能取得较好的效果。[5]
选用适宜的碱,可使反应也可停在1-溴代炔一步。溴代炔和末端炔烃是有机合成中很有用的官能团。[6]
反应机理
目前普遍接受的机理为,首先三苯基膦亲核进攻四溴化碳夺取一个溴离子,生成鏻离子,它受到同时生成的溴仿负离子的亲核取代,形成二溴亚甲基磷叶立德。之后与维蒂希反应类似,二溴亚甲基碳与醛羰基进行亲核加成,形成的两性中间体环化为氧磷杂环丁烷,进一步消除为三苯基氧膦和二溴烯烃。
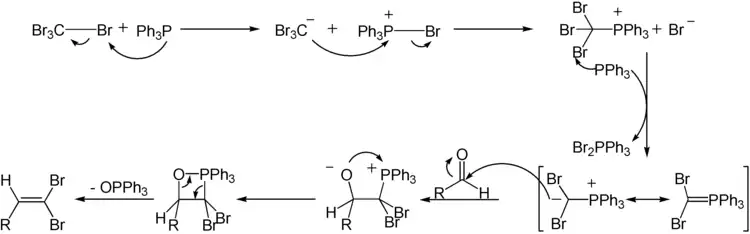
科里-富克斯反应的机理一
二溴烯烃与正丁基锂交换为锂代二溴烯烃,它发生β-消除生成溴代末炔。溴代末炔与正丁基锂再交换为末炔锂,末炔锂最后经水或卤代烃等亲电试剂处理,得末端炔或内炔。
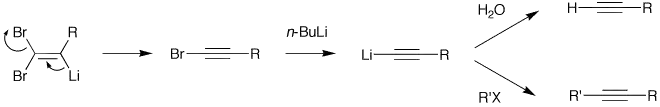
科里-富克斯反应的机理二
参考资料
- Corey, E. J.; Fuchs, P. L. . Tetrahedron Lett. 1972, 13 (36): 3769–3772. doi:10.1016/S0040-4039(01)94157-7.
- Mori, M.; Tonogaki, K.; Kinoshita, A. "Synthesis of 1,3-Dienes from Alkynes and Ethylene: Acetic Acid 2-Methylene-3-phenethylbut-3-enyl Ester (页面存档备份,存于)". Organic Syntheses, Vol. 81, p.1 (2005).
- Marshall, J. A.; Yanik, M. M.; Adams, N. D.; Ellis, K. C.; Chobanian, H. R. "Generation of Nonracemic 2-(t-Butyldimethylsilyloxy)-3-butynyllithium from (S)-Ethyl Lactate (页面存档备份,存于)". Organic Syntheses, Vol. 81, p.157 (2005).
- N. B. Desai, N. McKelvie. . J. Am. Chem. Soc. 1962, 84 (9): 1745–1747. doi:10.1021/ja00868a057.
- D. Grandjean, P. Pale and J. Chuche. . Tetrahedron Letters. 1994, 35 (21): 3529–3530. doi:10.1016/S0040-4039(00)73227-8.
- Craig M. Williams and Lewis N. Mander. . Org. Lett. 2003, 5 (19): 3499–3502. doi:10.1021/ol0353060.
- Zhe Wang, Silvio Campagna, Kaihong Yang, Guoyou Xu, Michael E. Pierce, Joseph. M. Fortunak, and Pat. N. Confalone. . J. Org. Chem. 2000, 65 (6): 1889–1891. doi:10.1021/jo9916582.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.