胰凝乳蛋白酶
胰凝乳蛋白酶(Chymotrypsin,bovine γ,PDB 1AB9,EC 3.4.21.1),也叫糜蛋白酶。胰凝乳蛋白酶是一種能够分解蛋白质的消化性酶,活性基团为丝氨酸(Ser or S),故属于丝氨酸蛋白酶。胰凝乳蛋白酶在酪氨酸(Tyr or Y)、色氨酸(Trp or W)和苯丙氨酸(Phe or F)(都是芳香族胺基酸)的羧基處切断肽键,从而裂解蛋白质。如果反应有足夠的時間,胰凝乳蛋白酶也可以水解是以亮氨酸(Leu or L)為主的羧基端肽键。
| 胰凝乳蛋白酶原B1 | |
|---|---|
 | |
| 識別 | |
| 符號 | CTRB1 |
| 替換符號 | CTRB |
| Entrez | 1504 |
| HUGO | 2521 |
| OMIM | 118890 |
| RefSeq | NM_001906 |
| UniProt | P17538 |
| 其他資料 | |
| EC編號 | 3.4.21.1 |
| 基因座 | 16 q23.1 |
| 胰凝乳蛋白酶原B2 | |
|---|---|
| 識別 | |
| 符號 | CTRB2 |
| Entrez | 440387 |
| HUGO | 2522 |
| RefSeq | NM_001025200 |
| UniProt | Q6GPI1 |
| 其他資料 | |
| 基因座 | 16 q22.3 |
| 胰凝乳蛋白酶C (caldecrin) | |
|---|---|
| 識別 | |
| 符號 | CTRC |
| Entrez | 11330 |
| HUGO | 2523 |
| OMIM | 601405 |
| RefSeq | NM_007272 |
| UniProt | Q99895 |
| 其他資料 | |
| 基因座 | 1 p36.21 |
活化
胰凝乳蛋白酶是在胰脏中被合成。开始合成的是胰凝乳蛋白酶原(胰凝乳蛋白酶的前体),不具有酶活性。在随胰液进入小肠后,被胰蛋白酶剪切为两部分(两部分之间依然通过二硫键相连),随后被剪切的胰凝乳蛋白酶原可以互相剪切去一段短的肽段,形成由二硫键相连的三条多肽链的具有完整活性的胰凝乳蛋白酶。
这种活化机制保证了胰凝乳蛋白酶只在体内特定地点获得催化活性,避免对机体造成损伤。
催化机制和动力学
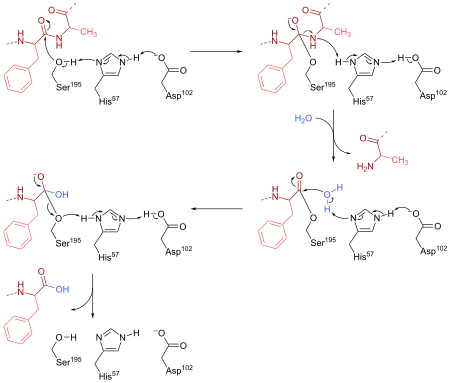
胰凝乳蛋白酶是在哺乳动物及其他动物体内的消化系统中发挥作用。它是通过催化一个水解反应(在没有酶催化的情况下,反应速度非常慢)来剪切肽键。胰凝乳蛋白酶的偏好受質包括酪氨酸、色氨酸、苯丙氨酸以及亮氨酸和甲硫氨酸。与其他蛋白酶相似,胰凝乳蛋白酶也可以在体外水解酯键;因此可以用一些受質类似物,如N-乙酰-L-酪氨酸对硝基苯酯,来作为酶反应试剂。
胰凝乳蛋白酶上195位丝氨酸残基的羟基氧是一个强的亲核物,可以进攻肽键上的羰基碳,使酶与底物共价连接形成短暂的酶-底物中间体,随后不稳定的肽键发生断裂。这一催化机制的发现是基于对酶与底物类似物(N-乙酰-L-酪氨酸对硝基苯酯)反应动力学的研究;由于反应产物对硝基苯酚显黄色,就可以通过在405nm下测量反应混合物的吸光值来计算产物浓度。
胰凝乳蛋白酶的催化反应可以分为两个阶段:开始时的快速反应和随后遵从米氏方程的稳定反应,又被称为“”机制。这一反应模式可以用胰凝乳蛋白酶催化的两个步骤来解释,即先乙酰化底物形成酶-底物中间物;再去乙酰化,酶回复到初始状态。
参考文献
- (英文)Stryer et al. (2002). Biochemistry (5th ed.). New York: Freeman. ISBN 0716746840.
- (英文)Garrett & Grisham. (2004). Biochemistry (3rd ed.). Brooks Cole. ISBN 0534490336.