自催化反应
自催化是指一個化學反應所生成之產物為該反應之催化劑。
若一組化學反應中一部分反應的產物足以催化其他反應,使得整組化學反應可自我供應能量和『食物分子』,則此組反應可稱作集體自催化(collectively autocatalytic)(參見autocatalytic set)
自催化反應速率方程
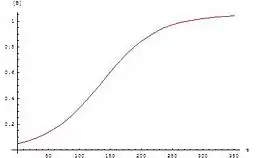
自催化反應中產物濃度的雙彎曲函數變化
二級自催化反應速率方程 是
A和B的濃度隨時間依據下式變化
與
典型的自催化反應等式圖形是雙彎曲函數:反應起初進行地很慢,因為幾乎沒有催化劑存在。反應速率隨著反應進行使催化劑量增加而加快,之後隨著濃度減少而減慢。若實驗的反應物或產物濃度遵守雙彎曲曲線,則此反應可能是自催化。
例如: 5 C2O42-(aq) + 2 MnO4-(aq)+16 H+(aq) →10 CO2(g) + 2 Mn2+(aq)+ 8 H2O(l)
其反應式右側的生成物Mn2+為該反應的催化劑,反應會隨著Mn2+濃度的增加,逐漸加快。
自然發生假說
1995年史都華考夫曼提出生命最初起源形式是自催化化學網狀系統。[1]
英國動物行為學家理察·道金斯在他2004年著作《祖先的故事》寫道自催化是無生源論的可能解釋。書中引用朱利叶斯·里贝克與同事在加州斯克里普斯研究所完成的實驗。該實驗中他們以自催化氨基腺苷三酸酯(autocatalyst amino adenosine triacid ester (AATE))合成氨基腺苷(amino adenosine)與五氟苯酯(pentafluorophenyl ester),其中一個來自實驗的系統包含了多種能自行催化自身合成的AATE。此實驗證明了自催化可能可以造成族群內以遺傳進行競爭,可解釋為早期形式的天擇
自催化反應實例
參見
- Stuart Kauffman. . Oxford University Press. 1995. ISBN 0195095995.
- Kovacs KA, Grof P, Burai L, Riedel M. . J. Phys. Chem. A. 2004, 108: 11026. doi:10.1021/jp047061u.
- Ecology, the Ascendent Perspective”, Robert Ulanowicz, Columbia Univ. Press 1997
- Investigations, Stuart Kauffman, Oxford University Press
相關條目
自催化反應與級數創建(Autocatalytic reactions and order creation)
外部連結
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.