转移氢化
转移氢化(英語:)是将氢气以外的氢源(一般是无机和有机金属化学中的两个氢原子)加成到分子中的反应过程,是工业和有机合成中重要的氢化方法,相较于直接使用氢气更加方便和廉价。转移氢化的一种大规模应用是使用供体溶剂(如四氢化萘)进行煤液化。[1][2]
有机金属催化
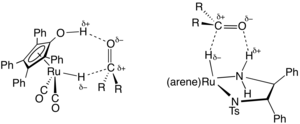
在有机合成领域,一类带有二胺和膦配体的钌、铑基配合物催化转移氢化的有机金属催化剂已经广泛应用于极性不饱和键的加氢。[3]其中代表性的催化剂前体由二氯双(4-甲基异丙基苯基)钌(II)和对甲苯磺酸化的1,2-二苯基乙二胺衍生化而来,它们可以将酮(C=O)、亚胺(C=N)还原为醇和胺。氢供体一般是异丙醇,反应后转化为丙酮。如果反应原料是前手性分子,那么转移氢化反应将会有高对映选择性:
- RR'C=O + (Me)2CHOH → RR'C*H-OH + (Me)2C=O
式中RR'C*H-OH是手性分子,催化剂是(对甲基异丙苯)R,R-HNCHPhCHPhNTs,其中Ts是SO2C6H4Me,R,R代表两个手性碳中心的绝对构型。野依良治因该项工作而获得了2001年诺贝尔化学奖。[4]
另一类转移氢化试剂基于醇铝盐的,如米尔温–庞多夫–韦尔莱还原反应中的异丙醇铝;然而与过渡金属催化剂相比,其活性较低。
非金属路线
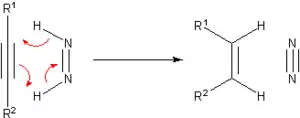
在开发催化加氢路线以前,就存在许多基于不饱和底物的氢化方法,现在其中的许多方法仅具有教学意义。其中一种著名的转移氢化试剂是二亚胺,它被氧化为稳定的氮气而进行转移氢化:
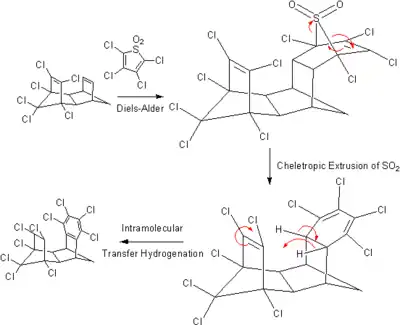
有环己烯或环己二烯结构的烃也能作为氢供体,反应中生成的稳定的苯结构可能是此类反应的驱动力。钯可作为此类反应的催化剂,反应温度约100℃。许多有趣的此类转移氢化反应近来被报道,例如分子内转移氢化:
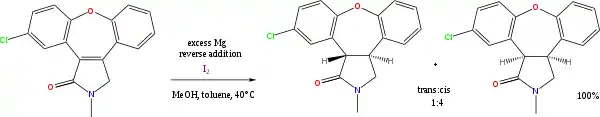
许多反应会以醇或胺作为质子供体,碱金属作为电子供体,进行氢转移反应。比较有价值的有Birch还原芳烃,稍微不太重要的有Bouveault-Blanc还原酯。镁和甲醇可用于烯烃的还原,例如阿塞那平的合成:[5]
有机催化
李斯特的小组在2004年以Hantzsch酯作为氢供体和胺催化的体系中提到了有机催化转移氢化反应:[6]
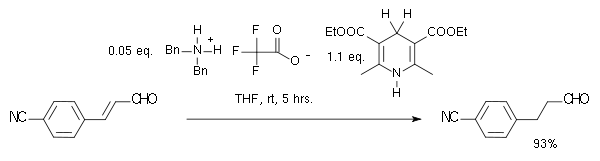
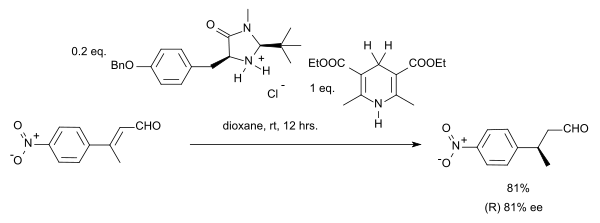
在该反应中,底物是α,β-不饱和羰基化合物,质子供体被氧化成类吡啶结构。在该反应的催化循环中,胺与醛先缩合成了亚胺离子,之后亚胺离子水解,质子转移再次形成了催化剂。通过采用手性咪唑烷酮结构的MacMillan有机催化剂,该反应获得了81%ee的对映选择性:[7]
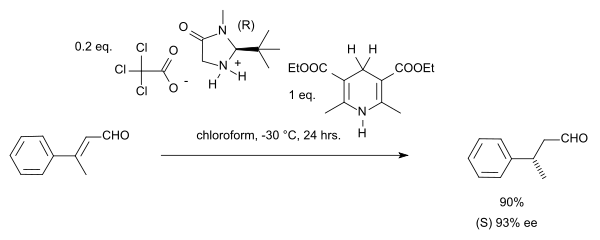
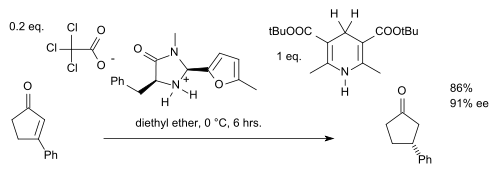
由于立体汇聚现象,此类反应中的Z/E异构体都会产生(S)-对映异构体。若想将此反应拓展到酮或α,β-不饱和(醛)酮则需要调整催化剂(如添加苄基和呋喃结构,在Hantzsch酯中使用空间位阻更大的叔丁基等):[8]
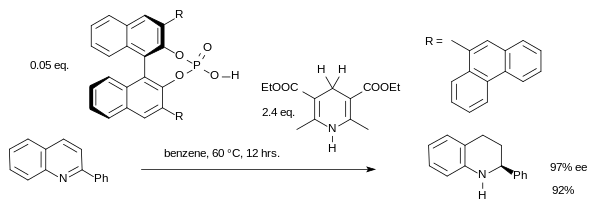
使用手性磷酸催化剂,也可以对亚胺进行转移氢化:[9]
此类反应通过手性亚胺离子进行。传统的金属催化剂在对芳族或杂芳族底物的氢化往往效果不佳。
参考文献
- Speight, J. G. "The Chemistry and Technology of Coal" Marcel Dekker; New York, 1983; p. 226 ff. ISBN 0-8247-1915-8.
- Muñiz, Kilian. . Angewandte Chemie International Edition. 2005, 44 (41): 6622–6627. PMID 16187395. doi:10.1002/anie.200501787.
- T. Ikariya, K. Murata, R. Noyori "Bifunctional Transition Metal-Based Molecular Catalysts for Asymmetric Syntheses" Org. Biomol. Chem., 2006, volume 4, 393-406.
- Shimizu, H., Nagasaki, I., Matsumura, K., Sayo, N., and Saito, T. "Developments in Asymmetric Hydrogenation from an Industrial Perspective" Acc. Chem. Res. 2007, vol. 40, pp. 1385-1393. doi:10.1021/ar700101x
- Linden, M. V. D.; Roeters, T.; Harting, R.; Stokkingreef, E.; Gelpke, A. S.; Kemperman, G. . Organic Process Research & Development. 2008, 12 (2): 196–201. doi:10.1021/op700240c.
- Yang; Hechavarria Fonseca, M.; List, B. . Angewandte Chemie International Edition in English. 2004, 43 (48): 6660–6662. PMID 15540245. doi:10.1002/anie.200461816
 .
. - Ouellet; Tuttle, J.; MacMillan, D. . Journal of the American Chemical Society. 2005, 127 (1): 32–33. PMID 15631434. doi:10.1021/ja043834g.
- Tuttle; Ouellet, S.; MacMillan, D. (PDF). Journal of the American Chemical Society. 2006, 128 (39): 12662–12663 [2022-06-08]. PMID 17002356. doi:10.1021/ja0653066. (原始内容 (PDF)存档于2018-07-25).
- Rueping; Antonchick, A.; Theissmann, T. . Angewandte Chemie International Edition in English. 2006, 45 (22): 3683–3686. PMID 16639754. doi:10.1002/anie.200600191.