过氧化钡
过氧化钡(化学式:BaO2)是钡的过氧化物,是最常见的无机过氧化物之一。室温下为灰白色固体,可用作氧化剂、漂白剂。加入至焰火中时[1]既可作氧化剂,也会产生钡特定的亮绿色光。
| 过氧化钡 | |
|---|---|
 | |
 | |
| IUPAC名 barium peroxide | |
| 识别 | |
| CAS号 | 1304-29-6 |
| PubChem | 14773 |
| ChemSpider | 14090 |
| SMILES |
|
| InChI |
|
| InChIKey | ZJRXSAYFZMGQFP-UHFFFAOYAZ |
| EINECS | 215-128-4 |
| RTECS | CR0175000 |
| 性质 | |
| 化学式 | BaO2 |
| 169.33 g·mol⁻¹ | |
| 外观 | 灰白色晶体 |
| 密度 | 4.95 g/cm³ (固) |
| 熔点 | 450 °C (723 K) |
| 沸点 | 800 °C (1073 K) (分解生成 BaO + O2) |
| 溶解性(水) | 微溶 |
| 危险性 | |
| 警示术语 | R:R8, R20/22 |
| 安全术语 | S:S2, S13, S27 |
| 主要危害 | 有害 (Xn) |
| NFPA 704 |
 0
1
0
OX
|
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
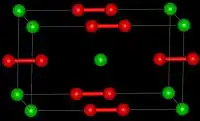
过氧化钡中含有过氧根离子O22−,固态时与碳化钙(CaC2)有相同结构。
氧化钡吸收O2会生成过氧化钡,该反应可逆,高于700°C过氧化钡分解:
- BaO +¹/₂O2 ⇌ BaO2
可用该反应来从大气中提取氧气,反应物也可选用氧化钠,机理类似。[2]
- BaO2 + H2SO4 → H2O2 + BaSO4
参见
参考资料
- . Data Sheet. Hummel Croton Inc. [2007-02-01]. (原始内容存档于2016-03-03).
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
外部链接
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.