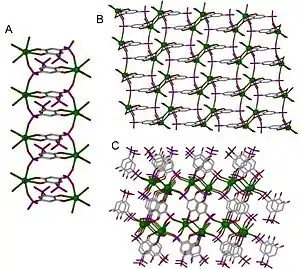
配位聚合物
配位聚合物是無機或含有金屬陽離子中心金屬有機聚合物藉由有機配體相連的結構。更正式的配位聚合物說法是具有重複的1,2或3個維度上延伸的配位實體。[1]
配位聚合物的重複單元是配合物。配位聚合物包含子類的配位網絡就是配位化合物的延伸,為1個維度上透過配位實體重複,與具有兩個或更多個單獨的鏈、環、螺形鏈接或透過配位實體在2或3維度上延伸在配位化合物之間的交叉連接。這些含有空洞的有機配體所產生的配位網絡有潛力應用在金屬-有機骨架材料方面。[1]
配位聚合物與許多領域相關,例如有機和無機化學,生物化學,材料學,電化學,和藥理學,都有很大應用潛力[2]。這個跨學科性質,使其在過去的幾十年裡一直被廣泛的研究[3]。
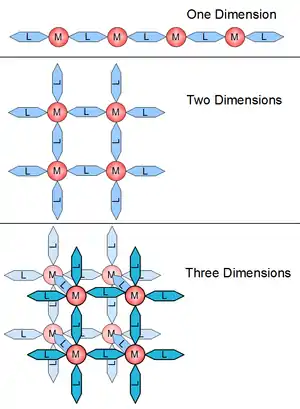
配位聚合物可以根據它們的結構和組成分成許多不同的方法。一個重要的分類被稱為維度。一個結構可以被決定為一維,二維或三維是取決於在空間中其延伸方向的排列。一維結構以直線延伸(沿著x軸);二維結構在平面中延伸(兩個方向為X和Y軸);而三維結構向三個方向延伸(X,Y,和Z軸)[4]。敘述於右圖:
歷史
阿尔弗雷德·维尔纳和他同時代的諾貝爾獲獎作品奠定了配位聚合物的研究基礎。普遍存在這方面的領域,例如配位數,由沃納創造。許多很久時間研究的材料現在被確定為配位聚合物。這些包括氰化物複合物普魯士藍(Prussian blue)和霍夫曼包合物。[5]
合成與傳遞
配位聚合物通常透過分子自組裝合成,涉及金屬鹽與配體的結晶;和分子自組裝合成的機制相關[2]。
用來產生配位聚合物的合成方法通常與用於生成任何晶體的方法相同。這些一般包括溶劑分層(緩慢擴散),緩慢揮發,緩慢冷卻。得知配位聚合物特性表徵的主要方法是X射线晶体学,因此使晶體生長到足夠尺寸和質量非常重要。
分子間作用力與鍵結
金屬-配體錯合物的分子間作用力包括范德华力,π-π相互作用,氫鍵,和π鍵的穩定是透過除了金屬和配體之間形成的配位鍵之外的極性鍵。這些分子間作用力因為其鍵長較長,而比共價鍵弱。苯環之間π-π的相互作用,例如:兩個平行的苯環間,能量大約5-10千焦/莫耳,間距大約在3.4-3.8埃。
配位
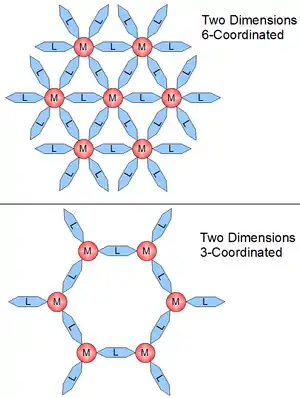
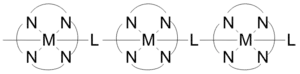
配位聚合物的晶體結構和維度的連接是由配位的金屬中心的幾何形狀來決定。維度通常是由配位聚合物的金屬中心對於鍵結到例如16功能位點上的能力來驅動。這些可能產生的鍵結就是配位數。配位數的大小通常是2到10之間,而且每個鍵結點會因為鍵角而互相分開。圖2為平面結構的配位數。圖1中的1-D結構是2個配位數,平面是4個配位數,和3D是6個配位數。圖3中的三個結構表示可以藉由改變中心原子而造成配位聚合物的幾何結構改變。
金屬中心
金屬中心,也被稱為節點,會依鍵角而有特定的鍵結數,鍵結到位點上。位點鍵結到一個節點的數量稱為配位數,而鍵角用來決定結構的維度。金屬中心的配位數與配合物结构是因為其周圍電子密度分布不平均而造成,且通常配位數會隨陽離子大小增加而增加。在幾種模式中,最常見的是混成模型和分子軌道理論,且因為環境對電子密度分佈的影響相當複雜,而用薛丁格方程()來預測和解釋配位幾何形狀[7]。
過渡金屬
過渡金屬通常可以用來當作節點。因為電子填充部分的d軌道,因此無論是在原子或離子狀態,會因為環境不同而有不同的混成軌域。這種電子結構使他們可以有更多種不同的配位幾何構造,特別是銅離子和金離子,因為中性原子有足夠的電子能夠填滿d軌域。
鑭系元素
鑭系元素是屬於大的原子,具有不同配位數,通常為7至10個。鑭系配位錯合物的環境對於配位數的影響很難預測,因此它們當成節點使用時,具有相當的難度。鑭系元素有摻入發光元件的可能性。
配體
在大多數配位聚合物,配位體(原子或原子團)會提供孤對電子給金屬陽離子並形成經由一種路易斯酸/鹼關係的配合物。配位聚合物形成時的配位體具有形成多個配位鍵與作為多金屬中心之間的橋樑的能力。配體可以形成一個配位鍵稱為單齒(monodentate),或形成多個配位鍵的配位聚合物稱為多齒。多齒的配位體相當重要,因為它會將多個金屬中心連接在一起形成一個無限陣列的配體。多齒的配體也可形成多重鍵,鍵結多個相同的金屬(稱為螯合)。單齒的配體也被稱為終端,因為它們不會提供可以連續鍵結的網絡。通常在這個情況下,配位聚合物會包括多齒和單齒,橋接,螯合劑,和終端配體的組合。
化學組成
幾乎任何類型且具有孤對電子的原子可以加入形成配位體。在配位聚合物中常見的配體包括聚吡啶(polypyridines),菲咯啉(phenanthrolines),羥基喹啉(hydroxyquinolines)和聚羧酸鹽(polycarboxylates)。氧原子跟氮原子是非常普遍的接合位點,還有其他的原子,例如:已經被觀察到的硫[9]和磷。[10][11]

配體與金屬陽離子通常都會遵循軟硬酸鹼理論(HSAB)。
這表示更大、更大的軟性金屬(硬度較低)比較容易與較大有更多極化軟性(金屬)配體形成配位鍵,而小的非極化的硬性金屬較容易與小的非極化硬性金屬形成配位鍵。
結構定向
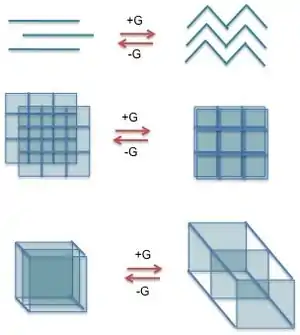
配體可以是柔性的或是剛性的。剛性配體是不能繞著鍵結自由旋轉或重新調整內部結構。柔性的配體可以彎曲,可以繞著鍵結自由旋轉,也可重新調整結構,這使它們可以有更多不同的結構。有一些例子顯示配位聚合物的結構包括相同配體的兩種組態,[12],以及兩個獨立的結構,其中它們之間唯一的區別是配體定向。圖4是柔性配體的例子。
其他因素
相對離子
除了金屬和配位體的選擇,還有許多因素會影響配位聚合物的結構。例如,大多數金屬中心帶正電的離子,平時以鹽形式存在。鹽當中的相對離子會影響整體結構。例如,銀鹽如硝酸銀,AgNO3, AgBF4, AgClO4, AgPF6, AgAsF6 and AgSbF 均與具有相同的配位體產生結晶,這些都與使金屬結構改變的配位環境和整個配位聚合物的維度相關。[13]
應用
配位聚合物可以當作商業化染料。特別是氨基苯酚(aminophenol)的衍生物。銅或鉻的金屬錯合物染料通常用於製備無光澤的顏色,因為三齒配位體染料相較於單齒與兩齒對應物更加有用、穩定。[16][17]

有一種早期商業化的配位聚合物是霍夫曼化合物,其化學式為 Ni(CN)4Ni(NH3)2 。這些材料會與較小的芳香族客體分子(苯,某些二甲苯)形成結晶,且因具此選擇性被用在商業化烴類的分離。[18]
研究趨勢
分子儲存
雖然尚未實用但多孔配位聚合物有相當潛力可與多孔碳和沸石一樣作為分子篩[5]。多孔配位聚合物的孔的大小和形狀可以由鏈接器的大小與連接配位體的鍵長和官能基團來控制。藉由修改孔徑大小,使吸收效率更高;非揮發性的客體分子會插(intercalated)在多孔配位聚合物的空間中來減小孔徑,活性表面的客體分子也可以促進吸收。例如,孔徑較大的MOF-177,直徑為11.8埃(Å),其可以通過 C60 分子(直徑為6.83埃(Å))或具有良好共軛系統的聚合物,增加表面積以增加對 H2 吸附。
柔性多孔配位聚合物在分子儲存方面有相當的潛力,因為它們的孔徑大小會因物理變化而改變。例如:在正常狀態下,聚合物含有氣體分子,經過壓縮後,聚合物的結構崩塌,釋放所儲存的氣體分子。柔性多孔配位聚合物的結構較有可塑性,而崩塌的孔洞是可逆的,因此該聚合物可以重新利用、吸收氣體分子[19]。前述的例子在金屬-有機骨架頁有詳細的介紹。
發光
螢光配位聚合物的典型特徵為有機發色團的配位體,會吸收光能,傳遞給金屬離子,使其激發。因為配位聚合物有發光的特性,可與客體分子耦合成為通用的發光物質。因此最近興起發光超分子結構在光電器件或作為螢光傳感器和探針方面的應用研究。配位聚合物比純有機物更穩定(耐熱與耐溶劑性)。不需要金屬連接劑的螢光配位體(不是因為LMCT)相較於單獨游離的配位體會發出強度較強的光。因此這些物質具有應用於發光二極管(LED)器件設計的潛力。螢光會有顯著的增加是因為剛性與不對稱的配位體配位到金屬中心增加而造成。[20]
導電率
配位聚合物的結構有短鏈的無機和共軛的有機鍵結可以提供導電的途徑。如圖所示,有些一維配位聚合物的導電率範圍在 1x10−6 到 2x10−1 S/cm之間。導電率是因為金屬的d軌道和鍵結配位體的pI*之間的相互作用。在某些情況下,配位聚合物可以具有半導電特性。當金屬中心整齊排列,則其三維結構包含片狀含銀聚合物可以表現半導電性,導電性會隨銀原子從平面轉移到垂直面而減少。[20]
參考文獻
- Batten, Stuart R.; Champness, Neil R.; Chen, Xiao-Ming; Garcia-Martinez, Javier; Kitagawa, Susumu; Öhrström, Lars; O’Keeffe, Michael; Suh, Myunghyun Paik; Reedijk, Jan. . Pure and Applied Chemistry. 2013-07-31, 85 (8): 1715–1724 [2020-09-20]. ISSN 0033-4545. doi:10.1351/PAC-REC-12-11-20. (原始内容存档于2021-01-05) (英语).
- Fromm, Katharina M. . Coordination Chemistry Reviews. 2008-04, 252 (8-9): 856–885 [2020-09-20]. doi:10.1016/j.ccr.2007.10.032. (原始内容存档于2020-06-07) (英语).
- Yang, Yong; Jiang, Guoqing; Li, Yi-Zhi; Bai, Junfeng; Pan, Yi; You, Xiao-Zeng. . Inorganica Chimica Acta. 2006-07, 359 (10): 3257–3263 [2020-09-20]. doi:10.1016/j.ica.2006.03.038. (原始内容存档于2020-02-20) (英语).
- Ye, B; Tong, M; Chen, X. . Coordination Chemistry Reviews. 2005-03, 249 (5-6): 545–565 [2020-09-20]. doi:10.1016/j.ccr.2004.07.006. (原始内容存档于2020-09-27) (英语).
- Kitagawa, Susumu; Kitaura, Ryo; Noro, Shin-ichiro. . Angewandte Chemie International Edition. 2004-04-26, 43 (18): 2334–2375. ISSN 1433-7851. doi:10.1002/anie.200300610 (英语).
- Côté, Adrien P.; Shimizu, George K. H. . Chemistry - A European Journal. 2003-11-07, 9 (21): 5361–5370. ISSN 0947-6539. doi:10.1002/chem.200305102 (英语).
- Bernstein, Jeremy, 1929-; Gasiorowicz, Stephen. . Upper Saddle River, NJ.: Prentice Hall. 2000: 624. ISBN 0-13-955311-8. OCLC 43118232.
- alkaline earth
- Wen, Ming; Munakata, Megumu; Suenaga, Yusaku; Kuroda-Sowa, Takayoshi; Maekawa, Masahiko; Yan, Sheng Gang. . Inorganica Chimica Acta. 2001-10, 322 (1-2): 133–137 [2020-09-20]. doi:10.1016/S0020-1693(01)00556-4. (原始内容存档于2020-02-09) (英语).
- Hung-Low, Fernando; Klausmeyer, Kevin K.; Gary, John Brannon. . Inorganica Chimica Acta. 2009-01-20, 362 (2): 426–436. ISSN 0020-1693. doi:10.1016/j.ica.2008.04.032 (英语).
- Ricci, Giovanni; Sommazzi, Anna; Masi, Francesco; Ricci, Marco; Boglia, Aldo; Leone, Giuseppe. . Coordination Chemistry Reviews. 2010-03, 254 (5-6): 661–676 [2020-09-20]. doi:10.1016/j.ccr.2009.09.023. (原始内容存档于2018-07-01) (英语).
- Knaust, Jacqueline M.; Keller, Steven W. . Inorganic Chemistry. 2002-11, 41 (22): 5650–5652. ISSN 0020-1669. doi:10.1021/ic025836c (英语).
- Carlucci, Lucia; Ciani, Gianfranco; Proserpio, Davide M.; Rizzato, Silvia. . CrystEngComm. 2002, 4 (22): 121. ISSN 1466-8033. doi:10.1039/b201288j (英语).
- Ni, Lu-Bin; Zhang, Rong-Hua; Liu, Qiong-Xin; Xia, Wen-Sheng; Wang, Hongxin; Zhou, Zhao-Hui. . Journal of Solid State Chemistry. 2009-10, 182 (10): 2698–2706 [2020-09-20]. PMC 2778864
 . PMID 20161370. doi:10.1016/j.jssc.2009.06.042. (原始内容存档于2020-03-03) (英语).
. PMID 20161370. doi:10.1016/j.jssc.2009.06.042. (原始内容存档于2020-03-03) (英语). - Tong, Ming-Liang; Hu, Sheng; Wang, Jing; Kitagawa, Susumu; Ng, Seik Weng. . Crystal Growth & Design. 2005-05, 5 (3): 837–839. ISSN 1528-7483. doi:10.1021/cg049610r (英语).
- Grychtol, Klaus; Mennicke, Winfried. . Wiley-VCH Verlag GmbH & Co. KGaA (编). . Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. 2000-06-15: a16_299. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a16_299 (英语).
- Atwood, Jerry L. . Wiley-VCH Verlag GmbH & Co. KGaA (编). . Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. 2000-06-15: a14_119. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a14_119 (英语).
- Atwood, Jerry L. . Wiley-VCH Verlag GmbH & Co. KGaA (编). . Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. 2000-06-15: a14_119. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a14_119 (英语).
- Bureekaew, Sareeya; Shimomura, Satoru; Kitagawa, Susumu. . Science and Technology of Advanced Materials. 2008-01, 9 (1): 014108 [2020-09-20]. ISSN 1468-6996. PMC 5099803
 . PMID 27877934. doi:10.1088/1468-6996/9/1/014108. (原始内容存档于2019-11-05) (英语).
. PMID 27877934. doi:10.1088/1468-6996/9/1/014108. (原始内容存档于2019-11-05) (英语). - BATTEN, STUART R. . ROYAL SOC OF CHEMISTRY. 2019. ISBN 1-78801-082-5. OCLC 1080276691.