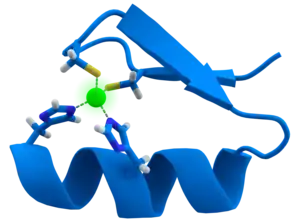
锌指
锌指(英語:),又稱鋅手指,是一种小的蛋白质结构模体,其特征在于配合一个或多个锌离子(Zn2+)以稳定折叠。最初用来描述非洲爪蟾卵母细胞转录因子IIIA假说结构的手指状外观,锌指名称现在已经包含了各种不同的蛋白质结构[1]。 在1983年,非洲爪蟾TFIIIA最初被证明含有锌,并且需要这种金属才能运行,这是被报道的第一个基因调节蛋白中具有锌的要求[2][3]。

这些具有锌指结构的蛋白大多都是与基因表达的调控有关的功能蛋白。锌指结构的共同特征是通过肽链中氨基酸残基的特征基团与Zn2+的结合来稳定一种很短的,可自我折叠成“手指”形状的的多肽空间构型。
含有锌指的蛋白(锌指蛋白)被分为几个不同的结构家族。大多數的超二級結構,包括希臘鑰匙、β髮夾,都已經被清楚定義。但鋅指的狀況並不是那麼簡單,含有鋅指的蛋白質大約分成幾類,每個鋅指結構都有相當特殊的三級結構,但其加上鋅離子的一級結構也是可以辨認配體。雖然鋅指之間有很大的變異,但大多是都是與DNA、RNA、蛋白質結合。
自从它们最初的发现和它们的结构阐明以来,这些相互作用的模块已经在生物世界中无处不在,并且可以在人类基因组的3%基因中被发现[4]。另外,锌指在各种治疗和研究能力方面已经变得非常有用。研究者會設計出特殊的鋅手指,使其有不同的親合性。鋅指核酸酶和鋅指轉錄因子是當今最重要的應用。
历史
锌指首先在阿龙·克卢格(Aaron Klug)实验室的爪蟾非洲爪蟾(Xenopus laevis)的转录研究中发现。 对特定RNA序列转录的研究表明,小转录因子(转录因子IIIA; TFIIIA)的结合强度是由于存在锌配位的手指状结构[5]。 TFIIIA的氨基酸测序揭示了9个30个氨基酸的串联序列,包括两个不变对的半胱氨酸和组氨酸残基。 扩展的X射线吸收精细结构证实了锌配体的身份:两个半胱氨酸和两个组氨酸[4]。 由这些配体锌配位形成的DNA结合环被认为与手指相似,因此被命名为[1]。 近来在各种生物体中表征蛋白质的工作已经揭示了锌离子在多肽稳定中的重要性[6][7]。
分类
最初,术语锌指仅用于描述非洲爪蟾中发现的DNA结合基序; 然而,它现在用于指代任何数量的与锌离子配位相关的结构。 一般而言,锌指与锌离子配合半胱氨酸和组氨酸残基。 最初,这些残基的数量和顺序被用于分类不同类型的锌指(例如,Cys2His2, Cys4, 和 Cys6)。 最近,一种更系统的方法已被用于分类锌指蛋白。 该方法根据折叠域中蛋白质骨架的整体形状将锌指蛋白分类为“折叠组(Fold Group)”。 锌指最常见的“折叠组”是Cys2His2-like(“经典锌指”),高音谱号(Treble clef),和锌带[8]。
下表[8] 显示了不同的结构及其主要特征:
| 折叠组 (Fold Group) | 代表结构 | 配体放置 |
|---|---|---|
| Cys2His2 |  | 两个配体形成一个关节,另外两个配体形成一个螺旋的c末端。 |
| Gag knuckle |  | 两个配体形成一个关节,另外两个形成短螺旋或环。 |
| 高音谱号 | 两个配体形成一个结,另外两个形成螺旋的N末端。 | |
| 锌带 |  | 两个配体各自形成两个关节。 |
| Zn2/Cys6 |  | 两个配体形成螺旋的N末端,另外两个形成环。 |
| TAZ2 domain like | 两个配体形成两个螺旋的末端。 |
Cys2His2
| Zinc finger, C2H2 type | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 鑑定 | |||||||||
| 標誌 | zf-C2H2 | ||||||||
| Pfam | PF00096(旧版) | ||||||||
| Pfam宗系 | CL0361(旧版) | ||||||||
| InterPro | IPR007087 | ||||||||
| PROSITE | PS00028 | ||||||||
| |||||||||
类Cys2β类折叠组迄今为锌指最佳特征类别,并且在哺乳动物转录因子中极为常见。 这些结构域采用简单的ββα折叠并具有氨基酸序列模体:[9]
X2-Cys-X2,4-Cys-X12-His-X3,4,5-His
这类锌指可以具有多种功能,如结合RNA和调节蛋白质-蛋白质相互作用,但以其在序列特异性DNA结合蛋白例如Zif268(Egr1)中的作用而闻名。 在这样的蛋白质中,单个锌指结构域通常作为具有包含蛋白质的DNA结合结构域的两个,三个或更多个指状物的串联重复发生。 这些串联阵列可以结合在DNA的大沟中,并且通常间隔3-bp间隔。 每个结构域的α-螺旋(通常称为“识别螺旋”)可以与DNA碱基进行序列特定性的接触; 来自单个识别螺旋的残基可以接触4个或更多个碱基以产生与相邻锌指的接触的重叠模式。
参阅
- 结构模体
- 序列模体
- 類轉錄活化因子核酸酶
- 锌指抑制剂
- 锌指核酸酶
- 锌指转录因子
參考資料
- Klug A, Rhodes D. . Cold Spring Harbor Symposia on Quantitative Biology. 1987, 52: 473–82. PMID 3135979. doi:10.1101/sqb.1987.052.01.054.
- Hanas JS, Hazuda DJ, Bogenhagen DF, Wu FY, Wu CW. . The Journal of Biological Chemistry. December 1983, 258 (23): 14120–5. PMID 6196359.
- Berg JM. . The Journal of Biological Chemistry. April 1990, 265 (12): 6513–6. PMID 2108957.
- Klug A. . Annual Review of Biochemistry. 2010, 79: 213–31 [2018-03-24]. PMID 20192761. doi:10.1146/annurev-biochem-010909-095056. (原始内容存档于2019-07-10). – Annual Reviews

- Miller J, McLachlan AD, Klug A. . The EMBO Journal. June 1985, 4 (6): 1609–14. PMC 554390
 . PMID 4040853.
. PMID 4040853. - Miller Y, Ma B, Nussinov R. . Proceedings of the National Academy of Sciences of the United States of America. May 2010, 107 (21): 9490–5. Bibcode:2010PNAS..107.9490M. PMC 2906839
 . PMID 20448202. doi:10.1073/pnas.0913114107.
. PMID 20448202. doi:10.1073/pnas.0913114107. - Low LY, Hernández H, Robinson CV, O'Brien R, Grossmann JG, Ladbury JE, Luisi B. . Journal of Molecular Biology. May 2002, 319 (1): 87–106. PMID 12051939. doi:10.1016/S0022-2836(02)00236-X.
- Krishna SS, Majumdar I, Grishin NV. . Nucleic Acids Research. January 2003, 31 (2): 532–50. PMC 140525
 . PMID 12527760. doi:10.1093/nar/gkg161.
. PMID 12527760. doi:10.1093/nar/gkg161.