阿糖腺苷
阿糖腺苷(英語:)又名9-β-D-阿拉伯呋喃糖基腺嘌呤(ara-A)(英語:),是一种抗病毒药,对单纯疱疹和水痘带状疱疹病毒有活性。
 | |
| 臨床資料 | |
|---|---|
| AHFS/Drugs.com | Micromedex详细消费者药物信息 |
| ATC碼 | |
| 藥物動力學數據 | |
| 血漿蛋白結合率 | 24-38% |
| 识别 | |
| |
| CAS号 | 24356-66-9 |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| NIAID ChemDB | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.024.449 |
| 化学 | |
| 化学式 | C10H13N5O4 |
| 摩尔质量 | 267.25 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
发现
1950年代,有科学家从生活在加勒比海的多孔动物Tethya crypta 体内分离出两个核苷:海绵啶和海绵脲;其中含有阿拉伯糖而非核糖。这些化合物的发现推动了新一代糖修饰的核苷类似物阿糖腺苷和相关化合物阿糖胞苷的合成。直至2004年,这两者是能应用于临床的仅有的相关化合物。[1]
该药物于1960年在斯坦福研究所的Bernard Randall Baker实验室中首次合成。[2]
该药物原本打算用作抗癌药。[2] M. Privat de Garilhe和J. De Rudder于1964年首次描述了阿糖腺苷的抗病毒活性。[3]它是第一个可以全身给药的核苷类似物抗病毒剂,也是第一个被许可用于治疗人类系统性单纯疱疹病毒 感染的药物。[4]阿拉巴馬大學伯明翰分校的研究员,医师Richard J. Whitley于1976年首次认识到阿糖腺苷的临床有效性,并使用阿糖腺苷治疗许多病毒性疾病。[3]
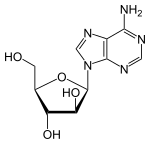
阿糖腺苷是腺苷的类似物,其中核糖被阿拉伯糖代替。从图1.1可以看出,它是腺苷的立体异构体。 它的血药半衰期为60分钟,其溶解度为0.05%,当其转换为其活性代谢产物时,还可以穿过血腦屏障。[5]
阿糖腺苷的作用机理
阿糖腺苷通过干扰病毒DNA的合成起作用[6]。它是核苷类似物,因此必须被磷酸化才能具有活性。这是一个三步过程,其中阿糖腺苷被激酶依次磷酸化为三磷酸ara-ATP。这是阿糖腺苷的活性形式,既是病毒DNA聚合酶的抑制剂又是其底物[7]。当用作病毒DNA聚合酶的底物时,ara-ATP竞争性地抑制dATP,导致“有缺陷的” DNA形成。这是将ara-ATP掺入DNA链中,取代许多腺苷碱基的地方。由于不能再建立磷酸二酯桥,使链不稳定,因此导致了DNA合成的阻止。维达拉滨三磷酸(ara-ATP)也抑制RNA聚腺苷酸化。防止HIV-1和其他逆转录病毒必不可少的聚腺苷酸化;和S-腺苷同型半胱氨酸水解酶,可防止转甲基反应。除阿糖腺苷外,二磷酸阿糖腺苷(ara-ADP)也具有抑制作用。其他核苷类似物需要进行三磷酸化才能产生任何抗病毒作用,但ara-ADP会抑制核糖核苷酸还原酶。
抵抗方式
阿糖腺苷比许多其他目前的抗病毒药如阿昔洛韦和更昔洛韦更具有毒性和代谢稳定性。抗阿糖腺苷的病毒株DNA聚合酶发生变化。很容易出现脱氨通过腺苷脱氨酶对肌苷[8]。这种代谢物仍然具有抗病毒活性,但效力比阿糖腺苷低10倍[9]。被肾脏清除的阿糖腺苷有60%作为尿液中的9-β-D-阿拉伯呋喃糖基次黄嘌呤排泄。嘌呤环也可能发生分解,形成尿酸。阿糖腺苷的结构修饰已证明在部分阻断脱氨方面有效,例如用甲氧基(ara-M)取代胺。这导致对水痘带状疱疹病毒的选择性比ara-A 高约10倍,但是阿糖腺苷的类似物由于不能被磷酸化而对其他病毒没有活性。也曾尝试使用腺苷脱氨酶抑制剂来延长阿糖腺苷的半衰期,并且已成功使用了诸如dCF和EHNA之类的药物。
合成、制备和分离
阿糖腺苷的化学合成最早于1960年完成,这是BR Baker等人研究开发潜在抗癌药的一部分[10],基于1-β-D-阿拉伯呋喃糖基尿嘧啶(ara-U)的独特生物学特性[11]。更具体地说,它的一些重要反应包括用2'-脱氧核糖核苷磷酸化酶,甲基转移酶或核苷磷酸化酶处理,得到相应的5'-磷酸,在其5位不产生甲基化,或糖基不裂解与5-氟-2'-脱氧尿苷相反[12]。这项较早的工作推动了对含阿糖腺苷的β-D-阿拉伯呋喃糖基部分的核苷的进一步合成研究[13],以及抗生素链霉菌发酵液中阿糖腺苷的分离[14]。 除了潜在的抗癌特性外,1965年还证实了阿糖腺苷的抗病毒活性[15]。特别值得一提的是有效的化学和酶促反应的合作,即从碳酸亚乙酯到尿苷的酯交换反应,同时自发地分子内消除二氧化碳得到2,2'-O-脱水-1-β-D-阿拉伯呋喃糖基尿嘧啶(anhydro-ara-U)[16]; 和脱水-ara-U的酸水解得到ara-U。然后将ara-U的糖部分酶促转糖基化为腺嘌呤的9位,同时保持β构型的完美保留[17]。最终,在1984年,这些开创性的合成导致了阿糖腺苷在日本的第一个商业化合成,商品名为“Arasena-A”。后来也报道了重复相同概念的酶促方法[18]。此外,在从ara-U到腺嘌呤的9位的酶促糖基化反应中用2-氟腺嘌呤替代腺嘌呤使得其能够有效合成2-氟-9-β-D-阿拉伯呋喃糖基腺嘌呤(氟达拉滨)[19]。
选择性
阿糖腺苷比其他抗病毒药(如IDU)更不容易产生耐药菌株,并已成功用于治疗IDU耐药病毒株。与未感染的细胞相比,在HSV感染的细胞中,活性三磷酸代谢物(ara-ATP)的半衰期长三倍[9],但是选择性的机制尚不清楚。
临床适应症
阿糖腺苷是一种抗病毒药,对疱疹病毒,痘病毒,弹状病毒,肝炎病毒和某些RNA肿瘤病毒具有活性。3%眼药膏Vira-A用于治疗由HSV-1和HSV-2引起的急性角膜结膜炎和复发性浅表性角膜炎[20]。维达拉滨还用于治疗艾滋病患者的带状疱疹,减少病变的形成和病毒脱落的持续时间。维达拉滨的许多先前用途已被阿昔洛韦取代,由于静脉内给药需要住院治疗,并且阿昔洛韦具有更高的选择性,更低的抑制浓度和更高的效力。毒性副作用很少见,但据报道,每天接受高剂量静脉注射的患者中,高浓度的阿糖腺苷有恶心,呕吐,白血球减少和血小板减少症的发生。
参考文献
- Kijjoa, A.; Sawangwong, P. Drugs and Cosmetics from the Sea. Mar. Drugs. 2004, 2, 73-82.
- Sneader, Walter. . New York: Wiley. 2005: 258. ISBN 0-471-89979-8.
- Field, H. J.; De Clercq, E. Antiviral Drugs – a short history of their discovery and development. Microbiology Today. 2004, 31, 58-61.
- White, O. D.; Fenner, F. J. Medicinal Virology. 3rd Ed.
- Waterson, A. P. Recent Advances in Clinical Virology (2).
- Merck Manual. 17th Ed. Chapter 154, p.1127-1128.
- McGuigan, C. Antiviral Chemotherapy – Cardiff University, 3rd Year Pharmacy Notes Lecture Notes.
- Whitley, R. J.; Tucker, B. C.; Kinkel, A. W.; Barton, N. H.; Pass, R. F.; Whelchel, J. D.; Cobbs, C. G.; Diethelm, A. G.; Buchanan, R. A. Pharmacology, Tolerance, and Antiviral Activity of Vidarabine Monophosphate In Humans.
- Burgers Medicinal Chemistry and Drug Discovery. 6th Ed.
- Lee, W. W.; Benitez, A. Goodman, L.; Baker, B. R. Potential Anticancer Agents. XL. Synthesis of the β-Anomer of 9-(D-Arabinofuranosyl)adenine, J. Am. Chem. Soc. 1960, 82, 2648–2649.
- Pizer, L. I.; Cohen, S. S. Abstr. 136th Meeting, Am. Chem. Soc., 1959, p. 9-C.
- Duschinsky, R.; Pleven, E.; Malvica, J. Heidelberger, C. Abstr. 132nd Meeting, Am. Chem. Soc., 1957, p. 19-C.
- Glaudemans, C. P. J.; Fletcher, Jr., H. G. Syntheses with Partially Benzylated Sugars. II. A Simple Pathway to a "Cisnucleoside," 9-β-D-Arabinofuranosyladenine (Spongoadenosine), J. Org. Chem., 1963, 28, 3004–3006; Reist, E. J.; Goodman, L. Synthesis of 9-β-D-Arabinofuranosylguanine, Biochemistry, 1964, 3, 15–18; Ikehara, M.; Ogiso, Y. Studies of Nucleosides and Nucleotides. LIV. Purine Cyclonucleosides - 19. Further Investigation on the Cleavage of the 8,2'-O-Anhydro Linkage. A New Synthesis of 9-β-D-Arabinofuranosyl-adenine, Tetrahedron, 1972, 28, 3695–3704; Ranganathan, R. A Novel Purine Nucleoside Synthesis of 9-β-D-arabinofuranosyl-adenine, Tetrahedron Lett., 1975, 1185 - 1188; Sowa, T.; Tsunoda, K. Novel Synthesis of Anhydronucleosides via 2',3'-O-Sulfinate of Purine Nucleosides as Intermediates, Bull. Chem. Soc. Jpn., 1975, 48, 3243–3245; Chattopadhyaya. J.; Reese, C. B. Reaction of 8,2'-O-Cycloadenosine with Hydrazine and Amines. Convenient Preparation of 9-β-D-Arabinofuranosyladenine, J. Chem. Soc., Chem. Commun., 1977, 414–415; Ishido, Y.; Sakairi, N.; Okazaki, K.; Nakazaki, N. Partial Protection of Carbohydrate Derivatives. Part 4. Regioselective 2'-O-Deacylation of Fully Acylated Purine and Pyrimidine Ribonucleosides with Hydroxyaminium Acetate, J. Chem. Soc., Perk. Trans. 1, 1980, 563–573.
- No inventor data available, Fermentation of 9-(β-D-Arabinofuranosyl)adenine, Brit. (1969) GB 1159290 1969–0723.
- De Rudder, J.; Privat de Garlhe, M. Inhibitory Effect of Some Nucleosides on the Growth of Various Human Viruses in Tissue Culture, Antimicrobial Agents and Chemotherapy, 1965, 5, 578 - 584; Miller, F. A.; Dixon, G. J.; Ehrlich, J.; Sloan, B. J. McLean, Jr., I. W. Antiviral Activity of 9-β-D-Arabinofuranosyladenine. I. Cell Culture Studies, ibid., 1968, 8, 136–147.
- Komura, H.; Yoshino, T.; Ishido, Y. An Easy Method of Preparing Cyclic Carbonates of Polyhydroxy Compounds by Transesterification with Ethylene Carbonate, Bull. Chem. Soc. Jpn., 1973, 46, 550–553.
- Utagawa, T.; Morisawa, H.; Miyoshi, T.; Yoshinaga, F.; Yamazaki, A.; Mitsusgi, K. A Novel and Simple Method for the Preparation of Adenine Arabinoside by Bacterial Transglycosylation Reactions, FEBS Lett., 1980, 109, 261 - 263; Yokozeki, K.; Yamanaka, F.; Utagawa, T.; Takinami, K.; Hirose, Y.,; Tanaka, A.; Sonomoto, K.; Fukui, S. Production of Adenine Arabinoside by Gel-Entrapped Cells of Enterobacter aerogenes in Water-Organic Cosolvent System, Eur. J. Microbiol. Biotechnol. 1982, 14, 225 - 231; Utagawa, T.; Morisawa, H.; Yamanaka, F.; Yamazaki, A.; Mitsugi, K.; Hirose, Y. Enzymatic Synthesis of Nucleoside Antibiotics. Part 1. Microbial Synthesis of Adenine Arabinoside, Agric. Biol. Chem., 1985, 49, 1053–1058,
- Roshevskaia, L. A.; Barai, V. N.; Zinchenko, A. I.; Kvasiuk, E. I.; Mikhailopulo, L. A. Preparative Synthesis of the Antiviral Nucleoside 9-β-D-Arabinofuranosyladenine by Using Bacterial Cells, Antibiot. Med. Biotekhnol., 1986, 31, 174–178.
- Caprioli, G; Colombo, P.; Farina, P.; Petricciani, L A process for the preparation of fludarabine phosphate from 2-fluroroadenine, EP1464708 A1, Oct. 6, 2004.
- Drug Information Online - https://www.drugs.com/MMX/Vidarabine.html (页面存档备份,存于)