烷烃
其名烷[9]雖為《集韻》裡收錄的字,读音同「完」,但化学家取「碳」右下角的「火」,加上「完」也造出此同形異義字;「碳」表示其结构中含有碳,而「完」表示其分子结构中碳原子化合价完足的意思[10]。
性質概論
烷類皆難溶於水,在完全燃燒下可轉化為二氧化碳和水[11],反應式如下:
烷類會因組合結構的不同,其性質可能會有極大的差異。若結構相似,則性質相近;若結構不同,性質不同。[11] 正因此,烷類種類繁多;但也由此許多化學式相同的物質,其性質不相同。如戊烷(C
5H
12)[12]:
| 結構圖 | IUPAC命名 | 普通命名 | 熔點 | 沸點 |
|---|---|---|---|---|
| 戊烷 | 正戊烷 | -130℃[13] | 36℃[13] | |
 | 2-甲基丁烷 | 异戊烷 | -160℃[14] | 27.85℃[14] |
 | 2,2-二甲基丙烷 | 新戊烷 | -19.5℃[15] | 9.5℃[15] |
物理性质
烷烴有許多物理性質:
- 密度皆小於1*10^3kg/m^3。即密度小于4摄氏度的水(常压)
- 不溶于水,但溶于有机溶剂。
- 熔点與沸点随著分子量增大和碳链增长而升高,同碳数的烷烃,支链越多沸点越低。
- 一般情况下,碳数小于5的烷類(甲烷到丁烷)为气态,5-16之间的烷類(戊烷到十六烷)为液态,17个碳(十七烷)及以上的烷類为固态(十七烷的熔点为21~23℃)。[16]
| 烷烴 | 化学式 | 沸點 [°C] | 熔點 [°C] | 20 °C下的狀態 | 密度 [g·cm3] |
| 甲烷 | CH4 | -162 | -182.5 | 氣體 | 0.000656 |
| 乙烷 | C2H6 | -89 | -182.8 | 氣體 | 0.00126 |
| 丙烷 | C3H8 | -42 | -187.7 | 氣體 | 0.00201 |
| 丁烷 | C4H10 | 0 | -138.0 | 氣體 | 0.00248 |
| 戊烷 | C5H12[17] | 35.2 [17] | -130 [17] | 液體 [17] | 0.649 [17] |
| 己烷 | C6H14 | 69 | -95 | 液體 | 0.659 |
| 庚烷 | C7H16[18] | 98.8 [18] | -91 [18] | 液體 [18] | 0.695 [18] |
| 辛烷 | C8H18[19] | 126 [19] | -57 [18] | 液體 [18] | 0.708 [18] |
| 壬烷 | C9H20[20] | 151.7 [20] | -53 [20] | 液體 [20] | 0.724 [20] |
| 癸烷 | C10H22 [21] | 174.9 [21] | -30 [21] | 液體 [21] | 0.734 [21] |
| 十一烷 | C11H24[22] | 196.3 [22] | -26 [22] | 液體 [22] | 0.743 [22] |
| 十二烷 | C12H26[23] | 216 [23] | -12 [23] | 液體 [23] | 0.753 [23] |
| 十六烷 | C16H34 | 287 | 18 | 液体[24] | 0.773 |
| 十七烷 | C17H36 | 302.2 | 22 | 固体 | 0.777[25] |
| 二十烷 | C20H42[26] | 343.4 [26] | 37 [26] | 固體 | 0.787 [26] |
| 三十烷 | C30H62 | 449.7 | 66 | 固體 | 0.810 |
| 四十烷 | C40H82 | 523.88[27] | 82 | 固體 | 0.817 |
| 五十烷 | C50H102 | 575 | 91 | 固體 | 0.824 |
化学性质
在正常情況下,烷烃性质很稳定,因为碳-氫键和碳-碳键相对稳定,难以断裂[28] 、以及烷烴不會搶奪官能團,所以不容易發生反應(如:不能使酸性高锰酸钾褪色;不能使溴水褪色),除了下面三种反应,小分子的烷烃几乎不能进行其他反应。但支链多的烷烃,键角可能不同于即109.5度,导致其容易發生反应。
燃燒反应
反應通式: CnH2n+2 + (3n+1)÷2 O2 → n CO2+ n+1 H2O
所有的烷烃都能燃烧,而且反应放热极多[29]。烷烃完全燃烧生成CO2和H2O[11]。如果O2的量不足,就会产生有毒气体一氧化碳(CO),甚至炭黑(C)[30]。(纯净的烷烃燃烧没有特殊的颜色,一般完全燃烧为淡蓝色,不完全燃烧为黄色或黄白色。)
以甲烷为例:
- CH4 + 2 O2 → CO2 + 2 H2O
O2供应不足时,反应如下:
- 2CH4 + 3 O2 → 2CO + 4 H2O
- CH4 + O2 → C + 2 H2O
分子量大的烷烃经常不能够完全燃烧,它们在燃烧时会有黑烟产生,就是炭黑。
卤代反应
反應通式:[註 1]
由于烷烃的结构太牢固,一般的有机反应不能进行。烷烃的卤代反应是一种自由基取代反应,反应的起始需要光能来产生自由基。
以下是甲烷被卤代的步骤。这个高度放热的反应可以引起爆炸。
- 链引发阶段:在紫外线的催化下形成两个Cl的自由基
- Cl2 → Cl* / *Cl
- 链增长阶段:一个H原子从甲烷中脱离;CH3Cl开始形成。
- CH4 + Cl*→ CH3* + HCl (慢)
- CH3* + Cl2 → CH3Cl + Cl*
- 链终止阶段:两个自由基重新组合
- Cl* 和 Cl*, 或
- R* 和 Cl*, 或
- CH3* 和 CH3*.[31]
裂解反应
裂化反应是大分子烃在高温、高压或有催化剂的条件下,分裂成小分子烃的过程。裂化反应属于消除反应,因此烷烃的裂化总是生成烯烃。如十六烷(C16H34)经裂化可得到辛烷(C8H18)和辛烯(C8H16)。
由于每个键的环境不同,断裂的机率也就不同,下面以丁烷的裂化为例讨论这一点:
- CH3-CH2-CH2-CH3 → CH4 + CH2=CH-CH3
- 过程中CH3-CH2键断裂,可能性为48%;
- CH3-CH2-CH2-CH3 → CH3-CH3 + CH2=CH2
- 过程中CH2-CH2键断裂,可能性为38%;
- CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2
- 过程中C-H键断裂,可能性为14%。[31]
裂化反应中,不同的条件能引发不同的机理,但反应过程类似。热分解过程中有碳自由基产生,催化裂化过程中产生碳正离子和氢负离子。这些极不稳定的中间体经过重排、键的断裂、氢的转移等步骤形成稳定的小分子烃。
在工业中,深度的裂化叫做裂解,裂解的产物都是气体,称为裂解气。
命名
烷類的命名多採IUPAC命名法。
命名烷類的首要步驟是分析其為環狀亦或是鏈狀,再進行命名步驟。[32]
鏈烷烴
化學通式:C
nH
2n+2[33]
鏈烷烴的命名步驟為:
- 找出最長的碳鏈當主鏈,依碳數命名主鏈,前十個以天干[註 2]代表碳數,碳數多於十個時,以中文數字命名,如:十一烷。
- 從最近的取代基位置編號:1、2、3...(使取代基的位置數字越小越好)。以數字代表取代基的位置。數字與中文數字之間以 - 隔開。
- 有多個取代基時,以取代基數字最小且最長的碳鏈當主鏈,並依甲基、乙基、丙基的順序列出所有取代基。
- 有兩個以上的取代基相同時,在取代基前面加入中文數字:一、二、三...,如:二甲基,其位置以“,”(逗号)隔開,一起列於取代基前面。
因為烷類一般簡單,故亦會使用「正、異、新」去區隔同樣化學式的烷類。IUPAC也曾推薦過此種命名方式[34]。例如己烷命名方式:
| 普通命名 | IUPAC命名 | 结构简式 | 结构式 |
|---|---|---|---|
| 己烷、 正己烷 |
己烷 | CH3(CH2)4CH3 | |
| 异己烷 | 2-甲基戊烷 | (CH3)2CH(CH2)2CH3 | 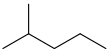 [36] [36] |
| 新己烷 | 2,2-二甲基丁烷 | CH3C(CH3)2CH2CH3 | 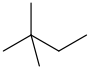 [37] [37] |
具多環的環烷烴的命名法
除非有俗名,否則具多環的環烷烴如桥环烷烴及螺环烷烴的命名較為複雜。名字包括表示環數量的前綴(如「二環」)、各環內碳原子總數的後綴以及表示各端點之間碳原子數的數字前綴(表示於中括號內。多個環公用的碳原子,即橋頭碳不計入內)。 如例一、例二:
heptane.svg.png.webp)
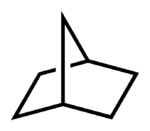
這個環烷總碳數為七,由兩個環組成,尾為「庚烷」,頭為「雙環」。兩個被共用的碳原子間有三個連接路線:一為五元環的部分,共三個碳(兩個橋頭碳不計入內,下同);二為四元環的部分,共二個碳;三為兩環之間共用的邊綫,只由兩橋頭碳直接連結,中間沒有碳。由此得出中括號內的數字(以降序表示數字之間用點分隔),[3.2.0]。故上圖的環烷名為二环[3.2.0]庚烷,而數字的個數總比環數多一個(在此有兩個環及三個數字)。「[3.2.0]二环庚烷」亦可接受,但環上有取代基時「二环[3.2.0]庚烷」有保留前面的位置的好處,方便加上其他含數字的前綴,以符合IUPAC命名常規。
上圖環烷總碳數為七,全為單鍵,詞尾為庚烷;兩共用碳間有兩對二碳碳鏈,也被一個碳原子連接著,故詞尾之前的數字前綴為[2,2,1](共用碳不計入內);這個環烷由兩個環組成,故前綴為「雙環」,最後得出「雙環[2.2.1]庚烷」。
特例
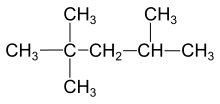
出于化工习惯,异辛烷不是2-甲基庚烷,而是2,2,4-三甲基戊烷。
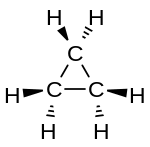
结构
烷烃中,每个碳原子都是四价的,采用sp3杂化轨道,与周围的4个碳或氢原子形成牢固的σ键,可以旋轉,故烷類無順反異構物。
为了使键的排斥力最小,连接在同一个碳上的四个原子形成四面体。甲烷是标准的正四面体形态,其键角为,大約等於109°28′。[39]
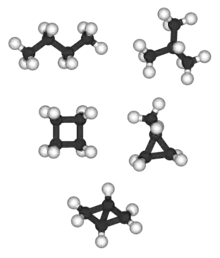
下面是前10种直链烷烃的分子式和结构模型图。
分佈
應用
工業上的應用
由于烷烃的制取成本较高(一般要用烯烃催化加氢),所以在工业上不制取烷烃,而是直接从石油中提取。由于烷烃不易发生反应,所以工业上也不把它作为化工基本原料。烷烃的作用主要是做燃料。天然气和沼气(主要成分为甲烷)是近来广泛使用的清洁能源。
由於烷烴大多來自於石油,所以必須經過分馏的過程,以得到各種不同用途的烷烴類。 分餾結果大約如下:
| 成分 | 碳數 | 分餾溫度 | 用途 |
|---|---|---|---|
| 石油氣 | C1–C4 | <20℃ | 燃料、化工原料 |
| 石油醚 | C5–C6 | 20℃-60℃ | 有機溶劑 |
| 汽油 | C7–C9 | 60℃-200℃ | 燃料 |
| 煤油 | C10–C16 | 175℃-300℃ | 燃料 |
| 柴油 | C15–C20 | 250℃-10,400℃ | 燃料 |
参考文献
- (PDF). [2011-10-04]. (原始内容存档 (PDF)于2020-08-03).
- . [2018-01-15]. (原始内容存档于2021-02-10).
- . [2017-08-27]. (原始内容存档于2021-02-06).
- . ChemYQ.com. [2011-10-04]. (原始内容存档于2020-12-25).
- . 嘉實資訊. [2011-10-04]. (原始内容存档于2020-08-03).
- . [2021-01-05]. (原始内容存档于2021-01-09).
- http://chem188.cn/Article/ShowArticle.asp?ArticleID=3409,其中亦有可能出现 (页面存档备份,存于)卤素,因为其价数和氢原子相同,为+1,所以可以取代氢原子。
- (PDF). Docs.google.com. [2017-08-17]. (原始内容存档 (PDF)于2020-08-03).
- . Zdic.net. [2017-08-17]. (原始内容存档于2013-06-16).
- http://dict.revised.moe.edu.tw/cgi-bin/cbdic/gsweb.cgi?o=dcbdic&searchid=W00000011486. [2017-08-17]. (原始内容存档于2021-01-28). 缺少或
|title=为空 (帮助) - 許立侖、許喆翔. . 康軒文教事業.
- 异戊烷
- . Chemicalbook.com. [2017-08-17]. (原始内容存档于2020-08-03).
- . Chemicalbook.com. [2017-08-17]. (原始内容存档于2020-08-03).
- . Chemicalbook.com. [2017-08-17]. (原始内容存档于2020-08-03).
- . Docs.google.com. [2017-08-17]. (原始内容存档于2020-08-03).
- . 化工百科. [2015-05-28]. (原始内容存档于2019-09-12).
- . 化工百科. [2015-05-28]. (原始内容存档于2019-09-12).
- . 化工百科. [2015-05-28]. (原始内容存档于2019-09-18).
- . 化工百科. [2015-05-28]. (原始内容存档于2019-09-13).
- . 化工百科. [2015-05-28]. (原始内容存档于2019-08-27).
- . 化工百科. [2015-05-28]. (原始内容存档于2019-09-03).
- . 化工百科. [2015-05-28]. (原始内容存档于2019-08-25).
- Record in the GESTIS Substance Database from the IFA
- she., Ren min jiao yu chu ban; 人民教育出版社. . Di 1 ban. Beijing: Ren min jiao yu chu ban she https://www.worldcat.org/oclc/666543370. 2004. ISBN 9787107176494. OCLC 666543370. 缺少或
|title=为空 (帮助) - . 化工百科. [2015-05-28]. (原始内容存档于2019-09-13).
- . [2020-03-27]. (原始内容存档于2020-12-25).
- 冀政勤、毛翰梅. . 台北市: 五南. 2001-02-22 [2011-09-19]. ISBN 957-11-2276-9. (原始内容存档于2015-02-21).
- . Content.edu.tw. [2017-08-17]. (原始内容存档于2014-02-26).
- . Highscope.ch.ntu.edu.tw. 2014-06-20 [2017-08-17]. (原始内容存档于2021-01-11).
- https://docs.google.com/viewer?a=v&q=cache:UylIK0hlBXMJ:163.23.148.7/sweb/pub/downfiles.php%3Frec_id%3D176%26rel_nm%3D1%26account%3Djiahui+%E7%83%B7%E9%A1%9E+%E7%87%83%E7%87%92&hl=zh-TW&gl=tw&pid=bl&srcid=ADGEESjVn_S4UBj386pOI7NtQloiuyGfCymgttRAfWW2AE_PJB9awjuKFypwR0q1w3QyFOwcCqsao9NApFyloGNUquPoILBB4iZ2ZHgi_DLolYLdP7zuIRY4qYXTKkczeEWQbTLiXZv4&sig=AHIEtbTaNJ-0RUBSkexAGhzfaapV4QNrZQ. [2017-08-17]. (原始内容存档于2020-12-25). 缺少或
|title=为空 (帮助) - 參考自IUPAC命名法
- Silderberg, 623
- Panico, R.; Powell, W. H. (编). . Oxford: Blackwell Science. 1994. ISBN 978-0-632-03488-8.
- . Chemyq.com. 2014-10-01 [2017-08-17]. (原始内容存档于2020-02-08).
- . Chemyq.com. 2014-10-01 [2017-08-17]. (原始内容存档于2019-07-12).
- . Chemblink.com. [2017-08-17]. (原始内容存档于2020-08-03).
- Merck Index, 11th Edition, 2755.
- . [2011-09-13]. (原始内容存档于2019-07-16).
- Bond dissociation energies: Senosiain, J. P.; Han, J. H.; Musgrave, C. B.; Golden, D. M. Faraday Discussions (2001), vol. 119, 173-189
- . Content.edu.tw. [2017-08-17]. (原始内容存档于2013-06-06).
- Meierhenrich, U. . Springer. 2008 [18 October 2008]. ISBN 978-3-540-76885-2. (原始内容存档于2009-09-05).
- Kim, S. J.; Caldwell, J.; Rivolo, A. R.; Wagner, R. . Icarus. 1985, 64: 233–48 [2007-08-28]. doi:10.1016/0019-1035(85)90201-5. (原始内容存档于2021-04-26).
- . Chinabaike.com. [2017-08-17]. (原始内容存档于2017-08-17).
- . [2011-09-15]. (原始内容存档于2010-09-06).
- http://www.natureasia.com/taiwan/nature/updates/index.php?i=5857&issue=7080%5B%5D
- Courtin, R.; Gautier, D.; Marten, A.; Bezard, B. . Bulletin of the American Astronomical Society. 1967, 15: 831 [2007-02-04]. (原始内容存档于2019-09-26).
- http://210.60.226.25/science/content/1986/00110203/0010.htm%5B%5D
- . Emfuel.com. [2017-08-17]. (原始内容存档于2021-04-17).
- . Chemed.chem.purdue.edu. [2017-08-17]. (原始内容存档于2009-04-25).
- (PDF) http://www.iupac.org/publications/pac/1983/pdf/5502x0199.pdf. [2017-08-17]. (原始内容存档 (PDF)于2017-08-30). 缺少或
|title=为空 (帮助) - . [2015-05-15]. (原始内容存档于2015-04-07).