高氯酸氯
高氯酸氯是分子式为Cl2O4的无机化合物。这种氯氧化物是不对称的,一个氯原子氧化态为+1而另一个为+7,准确的化学式应为ClOClO3。它可以用436nm的紫外线在室温下照射二氧化氯来制备:[1][2]
- 2 ClO2 → ClOClO3
| 高氯酸氯 | |
|---|---|
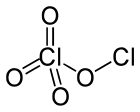 | |
| IUPAC名 Chlorine perchlorate | |
| 别名 | Dichlorine tetroxide |
| 识别 | |
| CAS号 | 27218-16-2 |
| PubChem | 168667 |
| ChemSpider | 147540 |
| SMILES |
|
| 性质 | |
| 化学式 | Cl2O4 |
| 134.904 g·mol⁻¹ | |
| 外观 | 苍绿色液体 |
| 密度 | 1.81 g/cm3 |
| 熔点 | -117±2 °C |
| 沸点 | 25 °C时分解 |
| 溶解性(水) | 反应 |
| 危险性 | |
| 主要危害 | 氧化剂 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
高氯酸氯是一个苍绿色的液体(《无机化学》丛书第六卷(P342)上在介绍这种物质的颜色的时候写的是“浅黄色”),常温下就会分解。
性质
高氯酸氯的化学性质十分活泼,在受热或震动时易爆。高氯酸氯的热稳定性小于高氯酸氟,大于高氯酸溴:
- CrO2Cl2 + 2 ClOClO3 → 2 Cl2 + CrO2(ClO4)2
- TiCl4 + 4 ClOClO3 → 4 Cl2 + Ti(ClO4)4
其他反应见下表[3]:
| 和高氯酸氯的反应物 | 条件 | 产物或部分产物 |
|---|---|---|
| — | 加热 | 六氧化二氯(80%)、二氧化氯、氯气、氧气 |
| — | 紫外线照射 | 七氧化二氯、氯气、氧气[4] |
| 氯化银 | 高氯酸银、氯气 | |
| 碘化铯 | -45℃ | Cs[I(OClO3)4][註 1] |
| ClOSO2F或ClF | MClO4(M=Cs或NO2)[註 2] | |
| 溴 | -45℃ | 高氯酸溴(BrOClO3)[註 2] |
| 碘(0.33mol) | -50℃ | I(OClO3)3[註 3][5] |
註:
用途
制备碘和溴的高氯酸盐。
参考资料
- A. J. Schell-Sorokin, D. S. Bethune, J. R. Lankard, M. M. T. Loy, P. P. Sorokin. . J. Phys. Chem. 1982, 86 (24): 4653–4655. doi:10.1021/j100221a001.
- M. I. Lopez, J. E. Sicre. . J. Phys. Chem. 1988, 92 (2): 563–564. doi:10.1021/j100313a062.
- 《无机化学》丛书.第六卷.P343.(c)卤素高氯酸盐.张青莲 主编
- Rao, Balaji; Anderson, Todd A.; Redder, Aaron; Jackson, W. Andrew. . Environmental Science & Technology. 2010-04-15, 44 (8): 2961–2967. ISSN 0013-936X. PMID 20345093. doi:10.1021/es903065f.
- Gomberg, M. . Journal of the American Chemical Society. 1923-02-01, 45 (2): 398–421. ISSN 0002-7863. doi:10.1021/ja01655a017.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.