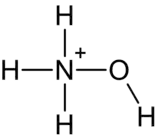
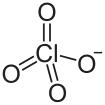
高氯酸羟胺
高氯酸羟胺是一种无机化合物,化学式为NH3OHClO4。
| 高氯酸羟胺 | ||
|---|---|---|
| ||
| 别名 | HAP 羟胺高氯酸盐 | |
| 识别 | ||
| CAS号 | 15588-62-2 | |
| PubChem | 167307 | |
| SMILES |
| |
| InChI |
| |
| InChIKey | BMMNWPYKMOFBBE-UHFFFAOYSA-N | |
| 性质 | ||
| 化学式 | H4ClNO5 | |
| 摩尔质量 | 133.49 g·mol−1 | |
| 外观 | 针状晶体[1] | |
| 熔点 | 87.5—88 °C(360.6—361.1 K)[2] | |
| 溶解性(水) | 易溶于水、乙醇、丙酮,微溶于乙醚,难溶于苯和四氯化碳[3] | |
| 危险性 | ||
GHS危险性符号 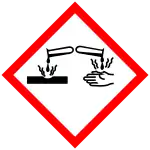   | ||
| GHS提示词 | 危险[4] | |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | ||
制备与结构
高氯酸羟胺可由略过量的硫酸羟胺和高氯酸钡反应制得,过量的硫酸羟胺可通过和碳酸钡反应去除。[3]硝酸在高氯酸中的电化学还原反应(锌或锡作为阴极)也可制得高氯酸羟胺。[1]它可通过乙醚-二氯甲烷重结晶[2],中子衍射表明,其晶体在25 °C时属P21cn空间群,晶胞参数a=7.52, b=7.14, c=15.99 Å,Z=8。[5]
热分解
高氯酸羟胺在180 °C开始分解,生成高氯酸铵。[3]其它检测到的分解产物还有HClO4、Cl2、O2、HCl、H2O、N2O和ClOx,其中H2O、HCl、N2O产量较多,200 °C以上时,生成NO2,且Cl2和O2增多。[2]
参考文献
- Kvaratskheliya, R. K. Electrosynthesis of hydroxylamine perchlorate(俄文). Issled. v Obl. Elektrokhim. i Radiats. Khim. Akad. Nauk Gruz. SSR, Inst. Neorgan. Khim. i Elektrokhim., 1965. pp 5-12.
- Herman F. Cordes, S. Ruven Smith. . Journal of Inorganic and Nuclear Chemistry. 1970-04, 32 (4): 1135–1139 [2021-08-31]. doi:10.1016/0022-1902(70)80107-5. (原始内容存档于2018-06-30) (英语).
- Zinov'ev, A. A.; Zakharova, I. A. Hydroxylammoninm perchlorate. Zhurnal Neorganicheskoi Khimii, 1960. 5: 775-777. ISSN 0044-457X.
- . ECHA. 2021-07-07 [2021-08-31]. (原始内容存档于2021-08-31).
- E. Prince, B. Dickens, J. J. Rush. . Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 1974-05-01, 30 (5): 1167–1172 [2021-08-31]. ISSN 0567-7408. doi:10.1107/S0567740874004493. (原始内容存档于2018-06-01).
- Grigorovich, Z. I.; Lyubimova, G. N. Reaction of hydroxylammonium perchlorate with calcium carbonate(俄文). Zhurnal Neorganicheskoi Khimii, 1981. 26 (9): 2564-2567. ISSN 0044-457X
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.