贝斯特曼-大平试剂
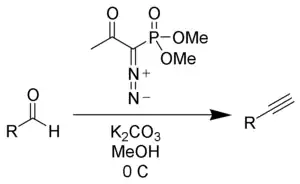
贝斯特曼-大平试剂,即1-重氮基-2-氧代丙基膦酸二甲酯,在反应时与甲醇和碳酸钾合用,首先经历一个缩合反应的逆反应,可以生成一个磷叶立德中间体。之后经过类似HWE试剂的机理,生成一个重氮化合物,并经过氢迁移得到产物炔烃。 由于在反应之中使用了碳酸钾作为碱,所以反应环境较为温和,使得这个试剂能够很好地在醛基原位高产率地生成端炔[1][2]。
贝斯特曼試劑
| 贝斯特曼-大平试剂 | |
|---|---|
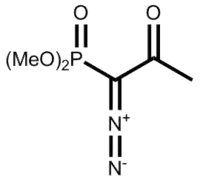 | |
| IUPAC名 dimethyl (1-diazo-2-oxopropyl)phosphonate 1-重氮基-2-氧代丙基膦酸二甲酯 | |
| 识别 | |
| CAS号 | 90965-06-3 |
| PubChem | 11106189 |
| ChemSpider | 9281325 |
| SMILES |
|
| InChI |
|
| InChIKey | SQHSJJGGWYIFCD-UHFFFAOYAK |
| 性质 | |
| 化学式 | C5H9N2O4P |
| 192.11 g·mol⁻¹ | |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
反应实例
与独立醛基的反应
在这里,首先,我们以2014年Taek Kang等在全合成(−)-Crinipellin A中所用到的一步反应为例[5]。他们在将一个含环氧的醇转化为末端的炔基时,合成小组首先利用草酰氯以及DMSO进行Swern氧化,将末端的羟甲基转化为醛基。随后,考虑到这个底物存在的不稳定性,合成人员使用了条件较为温和的Bestmann-Ohira试剂进行下一步的合成,两步的总收率为87%。
与α,β不饱和醛基化合物的反应
由于α,β不饱和醛基化合物是一个很好的共轭加成底物,由于体系中碱与甲醇的存在,底物先会发生共轭加成,在形成孤立醛基之后之后进一步发生成炔反应。
与α,β不饱和硝基化合物的反应
由于不饱和硝基化合物极度缺电子,所以在这类反应中,该试剂经逆酰基化反应后形成的中间体作为一个很好的1,3偶极子,能够与硝基烯烃发生[1,3]偶极环加成反应。反应后得到的产物消除HNO2,芳构化后便可得到芳香化合物吡唑。当反应原料是硝基苯等芳香硝基化合物时,产物为并吡唑环。[7]
与腈的反应
该试剂在铑催化剂催化下,将形成一个铑卡宾。当溶液中存在腈时,铑卡宾能和腈发生非协同反应,得到芳香的噁唑环。[8]
参考文献
- D. Seyferth, R. S. Marmor and P. Hilbert. J. Org. Chem. 1971, 36 (10): 1379–1386.
- J. C. Gilbert and U. Weerasooriya. Diazoethenes. J. Org. Chem. 1982, 47 (10): 1837–1845.
- Callant, P.; D’haenens, L.; Vandewalle, M. Synth. Commun. 1984, 14, 155.
- Pietruszka, J.; Witt, A. Synthesis 2006, 4266.
- Taek Kang, Seog Boem Song, Won-Yeob Kim, Byung Gyu Kim, and Hee-Yoon Lee. J. Am. Chem. Soc.2014, 136, 10274−10276.
- Dickson, H. D.; Smith, S. C.; Hinkle, K. W. Tetrahedron Lett. 2004, 45, 5597.
- Muruganantham, R.; Mobin, S. M.; Namboothiri, I. N. N. Org. Lett. 2007, 9, 1125.
- Gong, D.; Zhang, L.; Yuan, C. Synth. Commun. 2004, 34, 3259.
- Ohira, S. Synth. Commun. 1989, 19, 561.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.