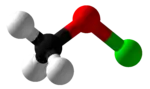
次氯酸甲酯
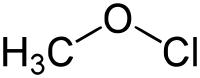
次氯酸甲酯是最简单的次氯酸酯,化学式为CH3OCl。它有一个同分异构体氯甲醇(ClCH2OH),这个化合物不稳定,会迅速脱氯化氢,生成甲醇。而次氯酸甲酯也较为不稳定,毒性很大,可爆炸性地分解,并生成有毒的甲醛和氯化氢气体。次氯酸甲酯是由Traugott Sandmeyer于1880年代首次合成的。[1]
| 次氯酸甲酯 | |||
|---|---|---|---|
 | |||
| |||
| IUPAC名 (Chlorooxy)methane | |||
| 系统名 Methyl hypochlorite | |||
| 别名 | 甲氧基氯 | ||
| 识别 | |||
| CAS号 | 593-78-2 | ||
| PubChem | 79056 | ||
| ChemSpider | 71388 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | UCFFGYASXIPWPD-UHFFFAOYSA-N | ||
| 性质 | |||
| 化学式 | CH3ClO | ||
| 摩尔质量 | 66.49 g·mol−1 | ||
| 外观 | 气体 | ||
| 氣味 | 刺激性 | ||
| 密度 | 1.058 g/cm3 | ||
| 熔点 | -120.4 °C(153 K) | ||
| 沸点 | 9.18 °C(282 K) | ||
| 溶解性(水) | 分解 | ||
| 折光度n D |
1.343 | ||
| 危险性 | |||
| 警示术语 | R:R3 R8 R23/24/25 R35 | ||
| NFPA 704 |
 0
4
4
| ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
结构
次氯酸甲酯在构型上类似于甲醇,其氢被氯取代:
| 化學鍵[2] | ||||
| 键 | 键的种类 | 电子结构 | 键长 | 离子成分 |
|---|---|---|---|---|
| C-H | σ | 2sp2-1s | 107 pm | 3% C- H+ |
| C-O | σ | 2sp3-2sp3 | 150 pm | 19% C+ O- |
| O-Cl | σ | 2sp2-3sp3 | 172 pm | 2% O- Cl+ |
| 统计学电荷[3] (各原子所带电荷,计算值) | ||||
| O | -0,21 | |||
| C | -0,10 | |||
| Cl | +0,02 | |||
| H (C-H) | +0,03 | |||
化学性质
次氯酸甲酯具有亲电的Cl+和亲核的CH3O-。
参考文献
- Sandmeyer, Traugott. . Berichte der Deutschen Chemischen Gesellschaft. January 1886, 19 (1): 857–861 [2022-10-21]. doi:10.1002/cber.188601901196. (原始内容存档于2022-10-21).
- Τα δεδομένα προέρχονται από τους πίνακες δεδομένων των στοιχείων άνθρακα, πυριτίου και υδρογόνου και τις πηγές«Table of periodic properties of the Ellements», Sagrent-Welch Scientidic Company και «Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982»
- Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 186, §7.3.1.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 267, §11.3.Α1, R = Cl, X = CH3O.
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 16-17, εφαρμογή γενικής αντίδρασης για Nu = CH3O.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.3., σελ. 22-25.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
拓展阅读
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.