Dötz反应
Dötz反应(Dötz reaction),又称Wulff-Dötz反应、Dotz反应
α-烷氧基亚苄基(或亚烯丙基)五羰基铬卡宾配合物(Fischer卡宾)与炔烃反应,生成 Cr(CO)3-配位的酚类。[1][2][3]
α,β-不饱和铬卡宾配合物与炔烃的芳环化反应最早是由德国化学家 Karl Heinz Dötz (1943-) 在1975年发现的。此后 Dötz 本人、Semmelhack 和美国化学家 William D. Wulff (1949-) 等小组都对这个反应的应用和机理有较为深入的研究。
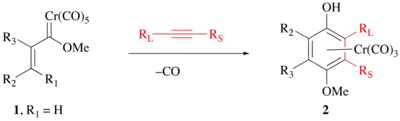
反应条件温和,有区域选择性(可以通过上图来预测)[6][7],对炔和卡宾上的官能团也有较强的耐受性。末端炔烃因此反应效果较好。
卡宾配体或炔烃所含的立体化学特征可促进非对映选择性的芳环化反应,从而用于光学活性的芳烃-Cr(CO)3 配合物的合成。芳族铬配合物经温和氧化(如用硝酸铈铵或空气),发生解配,得到游离的酚。
反应可用于合成高度官能团化的芳香族化合物,尤其是天然芳族产物(如维生素E和维生素K)。[8][9] 它提供了一种除亲电芳香取代和亲核芳香取代以外合成多取代芳香族化合物的方法。
反应机理
这个反应是以铬为模板,在其配位层发生的分步芳环构建过程。首先是卡宾配合物底物 (1)中的一个羰基与炔烃发生配体交换,生成 η2 的炔烃配合物中间体,这一步是速率控制步骤。实验证明这是一个两步过程[10],首先是羰基从 Fischer 卡宾上解离,生成配位不饱和(16电子)的四羰基卡宾中间体 (3),然后是炔烃与该中间体发生配位。计算显示炔烃与四羰基中间体的配位是低能垒过程, ΔE‡ = 8.37~16.74 kJ/mol (末端炔烃,B3LYP/SVP)。 该炔烃配合物的类似物已分离出来并被X射线衍射分析,结果显示该分子内炔基四羰基卡宾铬中具有较弱的炔烃-金属相互作用。[11]
然后炔烃配合物中的炔烃插入到卡宾键中,生成乙烯基卡宾配合物 (4),其中烯键构型可以是 (E) 或 (Z)。计算显示这一步的活化能垒为 12.55~37.66 kJ/mol (末炔,B3LYP/SVP)。以前曾有认为这一步首先为炔与卡宾的[2+2]环加成反应,产生四元的铬杂环丁烯中间体,然后再开环生成乙烯基卡宾。不过理论计算表明铬杂环丁烯中间体能量很高,已经排除这种可能性。[12]
接下来 (E) 构型的 (4)中的羰基分子内插入至金属-卡宾键中,得 η4 的乙烯基烯酮配合物中间体 (5)。
(5) 发生 6π 电环化反应,生成环己二烯酮配合物 (6)。 如果 R1 为 H, SiR3,则 (6) 最后发生1,3-迁移,经过互变异构,得到最终产物 Cr(CO)3 配位的酚。
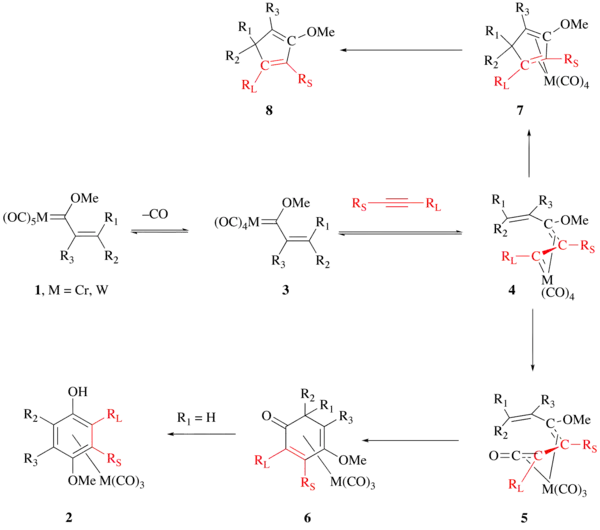
如果不发生 CO 插入,则反应经中间体 (7),得到副产物取代环戊二烯 (8)。
(Z) 构型的 (4)发生羰基插入生成的 (Z) 型的 (5),受构型所限,无法发生 6π 电环化。不过它可以经过环化、烃基迁移,得到副产物取代呋喃。
(E) 构型的 (5) 除发生 6π 电环化外,还可发生 4π 电环化,得到副产物取代环丁烯酮。
参见
参考资料
- Dötz, K. H. . Angew. Chem. Int. Ed. Engl. 1975, 14: 644–645. doi:10.1002/anie.197506442.
- Dötz, K. H.; Dietz, R.; von Imhof, A.; Lorenz, H.; Huttner, G. . Chem. Ber. 1976, 109: 2033. doi:10.1002/cber.19761090610.
- Timko, J. M.; Yamashita, A. (1998). "Synthesis of 2-substituted naphthalenediol derivatives using chromium carbene complexes: 1-acetoxy-2-butyl-4-methoxynaphthalene". Org. Synth.; Coll. Vol. 9: 1.
- Dötz, K. H. . Pure Appl. Chem. 1983, 55: 1689. doi:10.1351/pac198355111689.
- Dötz, K. H. New J. Chem. 1990, 14: 433–445. 缺少或
|title=为空 (帮助) - Wulff, W. D.; Tang, P. C.; McCallum, J. S. . J. Am. Chem. Soc. 1981, 103: 7677–7678. doi:10.1021/ja00415a058.
- Chamberlin, S.; Wulff, W. D. . J. Org. Chem. 1994, 59: 3047–3054. doi:10.1021/jo00090a024.
- Rawat, M.; Wulff, W. D. . Org. Lett. 2004, 6: 329–332. doi:10.1021/ol0360445.
- White, J. D.; Smits, H. . Org. Lett. 2005, 7: 235–238. doi:10.1021/ol047779s.
- Helmut Fischer and Peter Hofmann. . Organometallics. 1999, 18 (14): 2590–2592. doi:10.1021/om980958r.
- Prof. Dr. Karl Heinz Dötz, Dr. Thomas Schäfer, Friedrich Kroll, Klaus Harms. . Angew. Chem. Int. Ed. Engl. 1992, 31 (9): 1236–1238. doi:10.1002/anie.199212361.
- Prof. Dr. Peter Hofmann, Dipl.-Chem. Martin Hämmerle. . Angew. Chem. Int. Ed. Engl. 1989, 28 (7): 908–910. doi:10.1002/anie.198909081.