三氧化硫
三氧化硫(IUPAC名:,分子式:SO3)是一种硫的氧化物,有類似二氧化硫的氣味,溶於水中反應成硫酸。它的气体形式是一种严重的污染物,是形成酸雨的主要来源之一。
| 三氧化硫 | |||
|---|---|---|---|
| |||
| IUPAC名 Sulfur trioxide , Sulphur trioxide | |||
| 别名 | 硫酸酐 氧化硫(VI) | ||
| 识别 | |||
| CAS号 | 7446-11-9 | ||
| PubChem | 24682 22235242( (hemihydrate)) 23035042((monohydrate)) | ||
| ChemSpider | 23080 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | AKEJUJNQAAGONA-UHFFFAOYSA-N | ||
| Gmelin | 1448 | ||
| UN编号 | UN 1829 | ||
| EINECS | 231-197-3 | ||
| ChEBI | 29384 | ||
| RTECS | WT4830000 | ||
| 性质 | |||
| 80.06 g·mol⁻¹ | |||
| 外观 | 針狀固體或液體,有刺激性氣味 | ||
| 密度 | 1.92 g/cm3 | ||
| 熔点 | 16.9 °C, 62.4 °F | ||
| 沸点 | 45 °C, 113 °F | ||
| 溶解性(水) | 水解成硫酸 | ||
| 热力学 | |||
| ΔfHm⦵298K | −397.77 kJ/mol | ||
| S⦵298K | 256.77 J·K−1·mol−1 | ||
| 危险性 | |||
欧盟危险性符号 腐蚀性 C 腐蚀性 C | |||
| 警示术语 | R:R14-R35-R37 | ||
| 安全术语 | S:S1/2-S26-S30-S45 | ||
| NFPA 704 |
 0
3
3
OX
| ||
| 闪点 | 非易燃 | ||
| 致死量或浓度: | |||
LC50(中位浓度) |
大鼠, 4hr 375 mg/m3 | ||
| 相关物质 | |||
| 相关化学品 | 二氧化硫、硫酸、硫酰氯 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
在673K、1atm下,三氧化硫略有分解并达到平衡(三氧化硫含量99.2%),较低的温度与较高的压力有利于三氧化硫的稳定。但1173K时,三氧化硫完全分解。
结构
固态结构
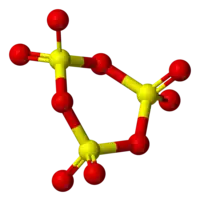
天然的SO3固体有一种令人惊讶的、因痕量水导致结构改变的复杂结构。[1] 由于气体的液化,极纯的SO3冷凝形成一种通常称作γ-SO3的三聚体。这种分子形式是一种熔点在16.8℃的无色固体。它形成的环状结构被称为[S(=O)2(μ-O)]3[2].
如果SO3在27℃以上冷凝,可形成熔点为62.3℃的α-"SO3" . α-SO3外观为类似石棉的纤维状(虽然两者相差甚远)。 在结构上来说,它是形如[S(=O)2(μ-O)]n的聚合物。聚合物分子的每个末端都以-OH结束(因此α-"SO3"并非真正是SO3的一个构型)。β-SO3是与α构型相类似、但相对分子质量不同的纤维状聚合物,其分子末端亦皆为羟基,熔点为32.5℃。γ构型和β构型都是介稳的,在长时间放置后最终会转化为稳定的α构型。这种转化是由痕量水导致的[3]。
在同一温度下固体SO3的相对蒸气压大小为α<β<γ,亦指明它们相对分子质量的大小。液态三氧化硫的蒸气压说明它是γ构型。因此加热α-SO3的晶体至其熔点时会导致蒸气压的突然升高,巨大的压力甚至可以冲破加热它的玻璃管。这个结果被称为α爆炸。[3]
制备
在实验室中三氧化硫可以通过硫酸氢钠的两步高温分解来制备:
- 脱水:
2 NaHSO4Na2S2O7 + H2O - 热分解:
Na2S2O7Na2SO4 + SO3
其他的金属硫酸氢盐同样在这个办法中适用,这个的关键在于中间媒介焦硫酸盐的稳定性。
SO3的工业制法是接触法。二氧化硫通常通过硫的燃烧或黄铁矿矿石(一种含硫铁矿石)的煅烧得到的,先通过静电沉淀进行提纯。提纯后的SO2在400至600°C的温度下,用负载在硅藻土上的含氧化钾或硫酸钾(助催剂)的五氧化二钒作为催化剂,将二氧化硫用氧气氧化为三氧化硫。铂同样可以充当这个反应的催化剂但是价格昂贵,比混合物更容易发生催化剂中毒(导致失效)。其催化机理为:
- 2 SO2 + V2O5 → 2 SO3 + V2O3
- V2O3 + O2 → V2O5
以这种方式制得的三氧化硫大部分都被转化为了硫酸,但不能用水进行吸收,否则将形成大量酸雾,但如果采用98.3%硫酸作吸收剂,因其液面上水、三氧化硫和硫酸的总蒸气压最低,故吸收效率最高。
另外,把硫酸銅在空氣中加熱至650°C,硫酸銅會分解成三氧化硫及氧化銅。
另一种方法是用一氧化氮催化氧化二氧化硫,但此法的缺陷是使用的一氧化氮剧毒(也有认为钒也是此反应的催化剂):
- 2SO2 + O22SO3
化学性质
SO3是硫酸(H2SO4)的酸酐,三氧化硫與水反應,釋放出大量的熱,而形成硫酸。因此,可以发生以下反应:
- SO3(𝑔) + H2O(𝑙) → H2SO4(𝑎𝑞)(Δ𝐻ᶱ=-88 kJ mol−1)
这个反应进行得非常迅速,而且是放热反应。在大约~340 °C以上时,硫酸、三氧化硫和水才可以在平衡浓度下共存。
此外,三氧化硫与一些碱土金属氧化物作用时可发光。
三氧化硫也与二氯化硫发生反应来生产很有用的试剂——亚硫酰氯。
- SO3 + SCl2 → SOCl2 + SO2
危害
人體吸入三氧化硫後,氣體進入呼吸道及肺,並溶於粘液,形成硫酸,腐蝕呼吸道。
来源
- WebElements(页面存档备份,存于)
- NIST Standard Reference Database(页面存档备份,存于)
- European Chemicals Bureau
- ChemSub Online: 三氧化硫(页面存档备份,存于)
- Public Health Statement for Sulfur Trioxide and Sulfuric Acid(页面存档备份,存于)
- http://www.chem-page.de/experimente/chemolumineszenz-mit-erdalkalieoxiden.html?highlight=WyJzbzMiLCJtZ28iXQ== (页面存档备份,存于)
参考文献
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Advanced Inorganic Chemistry by Cotton and Wilkinson, 2nd ed p543
- Merck Index of Chemicals and Drugs, 9th ed. monograph 8775