电解质
電解質(英語:[註 1])是指在水溶液或熔融狀態可以產生自由離子而導電的化合物。通常指在溶液中導電的物質,而固態可導電的物質則不算電解質。這包括大多數可溶性鹽、酸和鹼。有些氣體,例如氯化氫,在高溫或低壓的條件下也可以作為電解質。電解質通常分為強電解質和弱電解質。與此相對地,在溶液中可溶解但不導電的物質則稱為非電解質(英語:; anelectrolyte)。
历史

自1881年起,斯凡特·奥古斯特·阿伦尼乌斯开始在埃里克·艾德隆德的指导下进行电解质的相关研究。1884年,他向乌普萨拉大学提交了一篇长约150页的博士毕业论文,首次提出了“固体结晶盐在溶解时会分解成成对的带电粒子”这一观点,并通过离子的概念解释了电解质溶液的导电机理。他因此获得了1903年的诺贝尔化学奖。[1][2][3][4]
根据阿伦尼乌斯的观点,盐在形成溶液时会分解成一种带电粒子,这种粒子在很多年前便被麥可·法拉第命名为“离子”(ion)。麥可·法拉第认为离子是在电解时产生的,但阿伦尼乌斯认为即使在没有电流的情况下盐溶液也含有离子,所以溶液中的化学反应便是离子之间的反应。[5][6][7]
形成
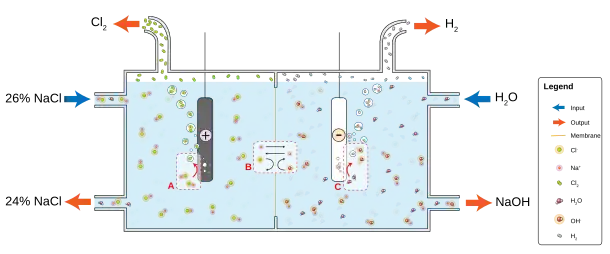
当酸,鹼,盐被置于溶剂中时往往会形成电解质溶液,在溶劑化时水和各个组分便会由于溶剂和溶质分子之间的热力学相互作用而离解。举个例子,根据离解反应,当氯化钠(NaCl)[註 2]置于水中时,固态盐会溶解成其成分中的离子[8]:
- NaCl(s) → Na+(aq) + Cl−(aq)
物质还可能与水反应并产生离子。例如,二氧化碳气体在水中溶解后会得到含有水合氢离子、碳酸根离子和碳酸氢根离子的溶液。
熔融盐也可以变为电解质。例如,氯化钠熔融时,液体导电。尤其是离子液体,它是一种熔点低于100℃的低温熔融盐[9]、高导电性的非水电解质,也正因此,它得以在各种电池中被越来越广泛的利用。[10]
应用
生理学
在生理学中,电解质的主要离子有钠(Na+)、钾(K+)、钙(Ca2+)、镁(Mg2+)、氯化物(Cl−)、磷酸(HPO42−)和碳酸氢盐 (HCO3−)。电荷符号正(+)和负( - ) 表明物质其实是具有离子性的,其电子的分布也并不平衡,而这正是化学离解的结果。钠离子是细胞外液的主要电解质,约占外液陽離子总量的92%;钾离子是细胞内液的主要电解质,约占內液陽離子总量的98%[11]。两者都是人体中最为重要的电解质[12],涉及到了體液平衡和血压控制。肌肉组织和神经元都被认作是人体中的电组织。
当患者长期呕吐或腹泻时需要补充电解质。电解质的监测在厌食或食欲过盛的治疗中也是非常重要的。
电化学
当电极置于电解质中并有电压被施加时,电解质将导电。单个电子通常不能通过电解质。在阴极处发生的化学反应会向电解质提供电子;而另一个反应在阳极发生,会消耗电解质中的电子。结果,阴极周围的电解质中产生了负电荷云,而阳极周围则形成了正电荷。电解质中的离子会中和这些电荷,从而使电子保持流动、反应继续进行。
例如在普通食盐(氯化钠,NaCl)的水溶液中,阴极反应将是:
氢气将会以气泡的形式浮上来,其阳极反应为:
氯气也会在反应中生成。带正电的钠离子Na +将向阴极反应,中和OH - 的负电荷;带负电的氢氧根离子OH-将朝向阳极反应,中和Na +的正电荷。
電離度
電解質在溶解之後,实际被电离的物质的摩尔比称为电离度(degree of electrolytic dissociation)。 通常用符号α表示。
电离度接近于1的物质被称为強電解質;而电离度低的物质则被称为弱電解質。
分类
强电解质(strong electrolyte)
相关条目
- 电解质紊乱
注释
- 電解質的英文單字electrolyte中,前綴-electro意即“電的”,-lyte借自古希臘語λυτός一詞,大意是“能夠解開或鬆開的”,與英語的loose同源。
- 俗称食盐
参考资料
- . Nobel Media. [5 January 2017]. (原始内容存档于2017-03-21) (英语).
- Harris, William; Levey, Judith (编). 4th. New York City: Columbia University. 1975: 155. ISBN 0-231035-721 (英语).
- McHenry, Charles (编). 1 15. Chicago: Encyclopedia Britannica, Inc. 1992: 587. ISBN 085-229553-7 (英语).
- Cillispie, Charles (编). 1. New York City: Charles Scribner's Sons. 1970: 296–302. ISBN 0-684101-122 (英语).
- Harris, William; Levey, Judith (编). 4th. New York City: Columbia University. 1975: 155. ISBN 0-231035-721 (英语).
- McHenry, Charles (编). 1 15. Chicago: Encyclopedia Britannica, Inc. 1992: 587. ISBN 085-229553-7 (英语).
- Cillispie, Charles (编). 1. New York City: Charles Scribner's Sons. 1970: 296–302. ISBN 0-684101-122 (英语).
- Kotz, John C.; Treichel, Paul M.; Townsend, John. 8. Cengage Learning. 2012: 127 [2017-02-27]. ISBN 9781133420071. (原始内容存档于2017-02-28) (英语).
- 石家华; 孙逊; 杨春和; 高青雨; 李永舫. (PDF). 化学通报 (北京). 2002, (4): 243 [2017-03-01]. ISSN 0441-3776. (原始内容 (PDF)存档于2017年3月2日) (中文).
- Jiangshui Luo; Jin Hu; Wolfgang Saak; Rüdiger Beckhaus; Gunther Wittstock; Ivo F. J. Vankelecom; Carsten Agert; Olaf Conrad. . 材料化学杂志(Journal of Materials Chemistry). 2011, 21: 10426–10436. doi:10.1039/C0JM04306K (英语).
- 叶胜龙; 汤钊猷. . 上海医学. 1986, (1): 1 [2017-03-03]. (原始内容存档于2017-03-03) (中文).
- 涂志全. 张定昌. . 中华中西医杂志. 2004, (10) (中文).
在正常人体内,钠离子占细胞外液阳离子总量的92%,钾离子占细胞内液阳离子总量的98%左右。钠、钾离子的相对平衡,维持着整个细胞的功能和结构的完整。钠、钾是人体内最主要的电解质成分...
- Kamil Perzyna; Regina Borkowska; Jaroslaw Syzdek; Aldona Zalewska; Wladyslaw Wieczorek. . Electrochimica Acta. 2011, 57: 58–65. doi:10.1016/j.electacta.2011.06.014 (英语).
- Jiangshui Luo; Annemette H. Jensen; Neil R. Brooks; Jeroen Sniekers; Martin Knipper; David Aili; Qingfeng Li; Bram Vanroy; Michael Wübbenhorst; Feng Yan; Luc Van Meervelt; Zhigang Shao; Jianhua Fang; Zheng-Hong Luo; Dirk E. De Vos; Koen Binnemans; Jan Fransaer. . 能源与环境科学(Energy & Environmental Science). 2015, 8. doi:10.1039/C4EE02280G (英语).
- 黄岳. . 化学世界. 1981, (8): 246 [2017-03-04]. ISSN 0367-6358. (原始内容存档于2017-03-04) (中文).
- 罗天美. . 四川文理学院学报. 2007, 17 (S1): 149 [2017-03-03]. ISSN 1674-5248. (原始内容存档于2017-03-04) (中文).
- 严宣申 (编). . . 28(化学卷). 中国大百科全书出版社: 155. [2017-02-27]. (原始内容存档于2017-02-28) (中文).
- 王丙利. . 中国医学导报. 2005, 2 (17). ISSN 1673-7210. doi:10.3969/j.issn.1673-7210.2005.17.049 (中文).
- 李鸿. . 化学教学. 1999, (7): 46 [2017-02-28]. (原始内容存档于2017-03-01) (中文).
- 周金祥. . 化学教学. 1998, (10) [2017-02-28]. (原始内容存档于2017-03-01) (中文).
一、醋酸铅尽管易溶于水,但属弱电解质,在溶液中以分子状...
- 周兴伟. . 中学化学. 2014, 0 (7): 15 [2017-02-28]. (原始内容存档于2017-03-01) (中文).
- 潘杰; 晏乃强; 瞿赞; 徐浩淼; 马永鹏; 陈万苗; 黄文君; 赵松建. . 环境科学学报 (上海). 2015, 35 (3): 665 [2017-02-28]. ISSN 0253-2468. (原始内容存档于2017-03-01) (中文).
- 刘斌. . 江苏教育. 1989, (10): 1. ISSN 1005-6009 (中文).
