卤素
鹵素(英語:)是指在元素週期表中同屬第17族(舊稱ⅦA族)的六種元素:氟(F)、氯(Cl)、溴(Br)、碘(I)、砈(At)和(Ts),砈和有極強放射性,且屬於人造元素。
鹵素是類化學性質非常活潑的元素,能和許多金属形成盐类。鹵素原子序越大,熔沸点越高;電負度與第一游離能越低,越不活潑;常温常压(300K、10萬Pa)的密度越高。卤族是唯一在常溫常壓有固液气三态元素的族。在标准状况,氟和氯是气体,溴是液体,碘、砈、鿬[1]是固体。
历史
含氟矿物萤石在1529年就已知。早期化学家就已知氟化合物裡有种未知元素,但无法分离。在1860年,英国化学家George Gore用电流流过氢氟酸的方法并可能产生了氟气,但他当时无法证明自己的结果。1886年,巴黎化学家亨利·莫瓦桑电解了溶于无水氟化氢的氟化氢钾,成功分离出氟。[2]
炼金术士和早期化学家早已知道盐酸,但1774年卡尔·威廉·舍勒加热盐酸和二氧化锰时才发现氯单质,他称之为dephlogisticated muriatic acid,也就是氯在这33年来的名字。1807年,咸夫里·戴维研究了氯,发现它是化学元素。氯氣在第一次世界大战期间用作化学武器。根据不同的污染濃度,氯气会灼伤人体内外的组织,尤其是肺部,使人呼吸困难或无法呼吸。[2]
安托萬·巴拉爾在1820年代將氯气通入卤盐水样品发现了溴。他最初提议为新元素命名为muride,但法兰西学术院将该元素改名为bromine(溴)。[2]
贝尔纳·库尔图瓦发现了碘。他通常将海藻灰与水煮沸来生成氯化钾,用以生产硝石。然而,在1811年,他在产物加入硫酸,发现产物生成紫色烟雾,这些烟雾凝结成黑色晶体。他怀疑这些晶体是新元素,因此将样品发给其他化学家来调查。约瑟夫·路易·盖-吕萨克证明了它是新元素,也就是今天的碘。[2]
1931年,弗雷德·艾利森自称用磁光机器发现了85号元素,并将其命名为Alabamine,但他的发现是错误的。1937年,拉真达拉·德(Rajendralal De)自称在矿石发现85号元素,并称其为dakine,但他的发现也是错误。霍里亞·胡盧貝伊和伊維特·哥舒瓦在1939年用光谱学尝试发现85号元素也未成功。瓦爾特·明德爾于同年尝试尋找由钋β衰变生成类似碘的元素。85号元素今天称为砹,于1940年由戴爾·R·科森、肯尼斯·羅斯·麥肯齊和埃米利奥·塞格雷成功合成,他们用α粒子轰击铋来合成砹。[2]
2010年,由核物理学家尤里·奥加涅相领导的团队,包含来自杜布纳联合原子核研究所、橡树岭国家实验室、劳伦斯利佛摩国家实验室和范德堡大学的科学家用钙-48轰擊锫-249原子合成出鿬-294。截至2024年3月,鿬是最新发现的化學元素。
命名
卤素可和很多金属形成氟化鈣、氯化鈉、溴化銀、碘化鉀等盐类,英文halogen来自希腊語halos(盐)和gennan(形成)两词。中文卤的原意是盐碱地。所有已发现卤素的英文名都以ine结尾。
1811年,德国化学家Johann Schweigger提议用halogen一名,意為「成盐者」,是希腊文αλς(als,意為盐)和γενειν(genein,意為产生),代替汉弗里·戴维提出的chlorine一名來稱呼氯元素;[3]不过,1826年,瑞典化学家约恩斯·贝尔塞柳斯提議把halogen一詞改為指代氟、氯和碘元素,這些元素与碱金属形成化合物时,會產生類似海鹽的物質。[4][5]
所有卤素名的结尾都有ine后缀。氟的名字来自拉丁语fluere,意為「流动」,它由矿物萤石衍生而来,而萤石在金属加工中用作助焊剂。氯的名字来自希腊文的chloros,意为黄绿色。溴的名字来自希腊文的bromos,意思是恶臭。碘的名字来自希腊文iodes,意为紫色。砹的名字来自希腊文的astatos,意为不稳定。鿬的名字则来自美国的田纳西州。[2][6]
分布
卤素在自然界以化合态广泛存在(極不穩定的砈和鿬除外)。氯的存在范围最广,其餘鹵素的含量按氟、溴、碘、砈、鿬顺序减少(砈在自然界只有痕量,鿬則不在自然界出現)。
| 卤素 | 分布状况[7] |
|---|---|
| 氟 | 在萤石、冰晶石、氟磷灰石等矿物出現(地壳质量分数:0.065%) |
| 氯 | 火成岩、沉积岩、海水、盐湖(地壳质量分数:0.031%;海水含量每公升20克) |
| 溴 | 岩石、海水、矿井水(地壳质量分数:0.00016%;海水含量每公升0.065克) |
| 碘 | 海水(含量5×10⁻⁸%)、智利硝石(含量0.02%~1%) |
| 砈 | 在某些含放射物質的地方,由其他放射性核種衰变生成(含量:少于1克)[8] |
| 鿬 | 以粒子加速器人工合成(含量:0克) |
性質
物理
|
名称 |
符号 |
主化合价 |
单质沸点,℃ | ||||
|---|---|---|---|---|---|---|---|
| 氟 | F | 0.071 | -1 | 气体 | 0.0017 | -219.62 | -188.12 |
| 氯 | Cl | 0.099 | -1,+1,+2,+3,+4,+5,+6,+7 | 氣体 | 0.0032 | -101.5 | -34.04 |
| 溴 | Br | 0.114 | -1,+1,+3,+4,+5,+7 | 液体 | 3.1028 | -7.3 | 58.8 |
| 碘 | I | 0.133 | -1,+1,+3,+5,+7 | 固体 | 4.933 | 113.7 | 184.3 |
| 砈 | At | 0.150 | -1,+1,+3,+5,+7 | 固体 | 6.2-6.5(推測)[9] | 302 | 337? |
| 鿬 | Ts | 0.156-0.157(推算)[10] | -1,+1,+3,+5(推測)[1] | 固体(推測)[1][10] | 7.1-7.3(推測)[10] | 350-550(推測)[11] | 610(推測)[11] |
化學
通常来说,液態卤素分子的沸点均高于对应的烃链,主要是卤素分子比烷链更电极化,而分子电极化增強分子间的连接力(正电极与负电极的相互吸引),我们需要对液体提供更多能量才能使其蒸发。
卤素单质都是双原子分子,亦很易挥发。鹵素的电子构型均为ns² np⁵,它们获取一粒电子以达到稳定结构的趋势极强烈,化学性质很活泼,在自然状态不能以单质存在,一般以-1价即卤离子(X⁻)形式在溶液及礦物出現。
| Z | 元素 | 核電外子構型 | 電子排布[注解 1] |
|---|---|---|---|
| 9 | 氟 | 2,7 | [He] 2s² 2p⁵ |
| 17 | 氯 | 2,8,7 | [Ne] 3s² 3p⁵ |
| 35 | 溴 | 2,8,18,7 | [Ar] 3d¹⁰ 4s² 4p⁵ |
| 53 | 碘 | 2,8,18,18,7 | [Kr] 4d¹⁰ 5s² 5p⁵ |
| 85 | 砈 | 2,8,18,32,18,7 | [Xe] 4f¹⁴ 5d¹⁰ 6s² 6p⁵ |
| 117 | 鿬 | 2,8,18,32,32,18,7(預測) | [Rn] 5f¹⁴ 6d¹⁰ 7s² 7p⁵(預測)[1] |
| 卤素 | 分子 | 結構 | 模型 | d(X−X),pm (氣態) | d(X−X),pm (固態) |
|---|---|---|---|---|---|
| 氟 | F₂ | 143 | 149 | ||
| 氯 | Cl₂ | 199 | 198 | ||
| 溴 | Br₂ |  | 228 | 227 | |
| 碘 | I₂ |  | 266 | 272 |
无机反应
氧化
卤素单质都是氧化劑,氧化力从氟到依次降低。碘单质氧化力较弱,三价铁离子可以把碘离子氧化为碘。卤素能与部分金属、非金属单质直接化合。卤素与水也能氧化还原:
- 2X₂+2H₂O → 4H⁺+4X⁻+O₂
氟与水反应剧烈,氯受光照与水缓慢反应,碘不反应。
歧化反应
卤素单质在碱中易歧化:
- X₂+2OH⁻(冷)→ X⁻+XO⁻+H₂O
- 3X₂+6OH⁻(热)→ 5X⁻+XO₃⁻+3H₂O
但在酸中很易逆反应:
- 5X⁻+XO₃⁻+6H⁺ → 3X₂+3H₂O
这反应是制取溴和碘单质流程的最后一步。
氢化物
卤素的氢化物叫卤化氢,为共价化合物;其溶液叫氢卤酸,它们在水中都以离子形式存在,且都是酸。一般而言氢氟酸(pKa=3.20)是弱酸。氢氯酸(即盐酸)、氢溴酸、氢碘酸都是典型的强酸,酸度从HCl到HI依次增强,它们的pKa均为负数。至於則為氫鹵酸中最強的酸,但它極易分解為氫與單質。[12]
氧化物
卤素的氧化物都是酸酐。二氧化氯(ClO₂)等偶氧化态氧化物是混酐。
| 卤素 | X₂O | X₂O₂ | X₂O₃ | XO₂ | X₂O₅ | X₂O₆ | X₂O₇ |
|---|---|---|---|---|---|---|---|
| 氟 | OF₂ | O₂F₂ | |||||
| 氯 | Cl₂O | ClO | Cl₂O₃ | ClO₂ | Cl₂O₅ | Cl₂O₆ | Cl₂O₇ |
| 溴 | Br₂O | Br₂O₃ | BrO₂ | Br₂O₅ | |||
| 碘 | I₂O₅ |
含氧酸
卤素(除了氟,氟只有-1价)可显示多种价态,正价态一般都出现在其含氧酸根。
以氯为例:
卤素的含氧酸均有氧化力,同一元素中,次卤酸最强。
卤素含氧酸多数只在溶液中,少数盐以固态存在,如碘酸盐和高碘酸盐。HXO(X為Cl、Br、I)、HIO₃和HXO₄(X為Cl、Br、I)分子在气相十分稳定,可用质谱和其他方法研究。卤素含氧酸见下表[13]290-291。
| 氟的含氧酸 | 氯的含氧酸 | 溴的含氧酸 | 碘的含氧酸 | |
|---|---|---|---|---|
| HXO(次卤酸) | HFO | HClO | HBrO | HIO |
| HXO₂(亚卤酸) | HClO₂ | HBrO₂ | HIO₂ | |
| HXO₃(卤酸) | HClO₃ | HBrO₃ | HIO₃ | |
| HXO₄(高卤酸) | HClO₄ | HBrO₄ | HIO₄ | |
| 其他 | H₇I₅O₁₄ | |||
| 其他 | H₅IO₆ |
互卤化物
只由两种卤素形成的化合物叫互卤化物,較电正的元素呈正氧化态,氧化态为奇数。卤素的价电子数是奇数,周围与奇数粒其它卤原子成键比较稳定(如IF₇)。互卤化物都能水解。
| 鹵素 | 氟 | 氯 | 溴 | 碘 | 砈 |
|---|---|---|---|---|---|
| 氟 | |||||
| 氯 | |||||
| 溴 | |||||
| 碘 | |||||
| 砈 |
其他无机化学性质
| F₂ | Cl₂ | Br₂ | I₂ | |
|---|---|---|---|---|
| 和鐵反应 | FeF₃ | FeCl₃ | FeBr₃ | FeI₂(碘的氧化力較弱) |
| 和氫氧化鈉反应 | NaF+OF₂ | NaCl+NaClO 加热反应则生成NaCl+NaClO₃ | NaBr+NaBrO 加热反应则生成NaBr+NaBrO₃ | NaI+NaIO₃ |
| 和硫反应 | SF₆ 也会产生SF₄ | S₂Cl₂ 在催化剂的作用下产生SCl₂ 低温下和低价硫的氯化物作用产生SCl₄ | S₂Br₂ | 不反应 |
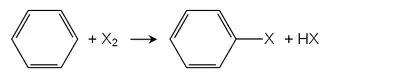
有机反应
在有机化学,卤族元素经常作为决定有机化合物化学性质的官能团存在,常用X表示,如R-X是含鹵原子的烴類。
卤素的物理特性和化学特性明显区分于与它对应的烃链的主要原因,在于卤素原子(如F、Cl、Br、I)与碳原子的连接,即碳-鹵的连接,明显不同于烃链碳-氫连接。
- 卤原子通常较电负,碳-鹵连接比碳-氫连接更加电极化,但仍然是共价键。
- 卤原子体积和质量通常较碳原子大,碳-鹵连接的偶极子矩(Dipole Moment)和连接能量(Bonding Energy)远大于碳-氫,碳-鹵的连接力(Bonding strength)远小于碳-氫连接。
- 卤原子脆弱的p轨道(Orbital)与碳原子稳定的sp³轨道相连接,碳-鹵连接不甚稳定。
卤素最常见的有机化学反应为亲核取代反应(nucleophilic substitution),通常的化学式如:
Nu:⁻+R-X → R-Nu+X⁻
“Nu:⁻”在这里代表亲核负离子,离子越亲核,产率和化学反应速度越可观。
“X”在这里代表卤素原子,如F、Cl、Br、I,若X⁻所对应的酸(即HX)为强酸,那么产率和反应的速度将非常可观,如果若X⁻所对应的酸为弱酸,则产率和反应的速度均会下降。
合成有機卤化物
Karasch方式
如想将溴加在烃链第一粒碳原子,可用Karasch方式:
CH₃-CH₂-CH=CH₂+HBr → CH₃-CH₂-CH₂-CH₂-Br+H₂O
以雙氧水催化,产率90%以上。
生产
含氟矿物萤石年開採约六百万公吨。氢氟酸年产約40万吨。由在磷酸生产中作为副产物产生的氢氟酸可制得氟气。氟气年产约15000公吨。[2]
石盐是最常用于开采氯的矿物,但光鹵石和钾石盐等矿物也可用于开采氯。每年還有約四千万吨的氯气以电解卤盐水的方法产生。[2]
溴年产约45万吨,一半来自美国,35%来自以色列,其余多来自中国。溴過去是在自然卤盐水添加硫酸和漂白粉生产;现代以赫伯特·亨利·道发明的电解法生产。溴也可由氯气通入海水,然后將空气通入海水生产。[2]
2003年全球碘产量约2.2萬公吨,智利生产四成、日本生产三成,另外少量由俄罗斯和美国生产:248。碘以前从海带提取出來,直到1950年代,现代以其他方式生产。产生碘的一种方法是将二氧化硫与硝酸盐矿石混合,其中含有一些碘酸盐。碘也可以从天然气田中提取。[2]
砹在鈾礦天然出現,但僅作為次要衰變產物痕量生成,且生成後會快速衰變,通常要在粒子加速器以α粒子轰击铋原子合成。[2]
鿬等超重元素皆不在自然界出現,只能藉粒子加速器人工合成。
用途
氟最大的用途是在核燃料循环生产六氟化鈾,每年消耗近7000吨。首先二氧化铀与氢氟酸反应生成四氟化铀,然后以氟气氟化四氟化铀生成六氟化鈾[14],可通过气体扩散法或者气体离心法浓缩铀[15][16]。每年大约有6000吨氟用于生产惰性电介质六氟化硫,该物质可以用于高压变压器与断路器,这样就不必在充油设备中使用危险的多氯联苯了[17]。电子产品中会使用一些氟化合物:在化学气相沉积中会使用六氟化钨或六氟化铼,在等离子蚀刻中会使用聚四氟乙烯[18][19][20][16]。此外氟也可用於牙齒護理、製藥及在血液中攜帶氧氣等。
氯可作为較便宜的消毒劑,一般的自来水及游泳池就常用它消毒,但氯氣頗難溶、甚毒、會放出特殊氣味,且易生成有致癌風險的三鹵甲烷等有机氯化合物,中、美等國常改用二氧化氯(ClO₂)、氯胺或臭氧等代替氯氣作為水的消毒劑。除了用於消毒,氯氣也是一种重要的化工原料,用於制造盐酸和漂白粉、制造氯代烃。也可以用于制造多种农药、制造氯仿等有机溶剂。此外氯氣還广泛用于造纸、纺织、有机合成、金属冶炼等行业,也有作為化學武器的紀錄。
許多種的有機溴化物在工業上有其應用,其中一部份是由溴製備而來,另一部份則是由溴化氫製備而來。溴化合物在工業可用於阻燃劑、汽油添加劑、鑽井液和化工原料等,用途十分廣泛。
碘化物的主要用途包括做為催化劑、動物食物添加品、穩定劑、染劑、著色劑、顏料、藥品、清潔衛生(碘酒)、照片與鹵素燈泡等;其他小眾用途為除霧、種雲,和在分析化學中的多種用途。此外其放射同位素碘131可用於醫學造影及放射治療。
砈的同位素皆非常不穩定,但砈211用於核醫學。[21]剛製成的砈211須馬上用,不然其總量在7.2小時之後就會減半。砹211會釋放α粒子,或經電子捕獲衰變成釋放α粒子的釙211,可用於α粒子靶向治療。[21]
只能用粒子加速器人工合成,極難製備,造出的量又極少(至多幾顆原子),生成後又會很快衰變,沒有任何商業用途,僅用於學術研究。
生物學作用及防護
氟并非人类或者其它哺乳动物必须的元素。有人認為少量的氟可能对增加骨强度有益,但该理论尚未确立。日常环境有很多微量氟的来源,只有人工饮食能使人缺氟[22][23]。至於吸入大量氟氣對人體來說是劇毒,會刺激眼、皮膚、呼吸道粘膜。
和氟相似,大量氯氣對人體來說也是劇毒,可損害人體全身器官及神經系統,但氯離子是人體必需的礦物質,在人體中為代謝作用很重要的物質,胃中生成鹽酸和細胞幫浦的功能皆需要氯,飲食中主要的來源是餐桌上的氯化鈉,血液中過低或高濃度的氯為電解質失調的實例,在沒有其他異常的情況下很少發生低氯血症。
溴在人體中還未找到已知功能,但有機溴化合物的確自然存在。海中的有機物是有機溴化合物的主要來源,例如海藻和骨螺等。溴會腐蝕及毒害人體,刺激皮膚及呼吸道粘膜等,且傷害神經系統及腸胃道等。
碘是人體必需的礦物質,用以製造甲狀腺素以調控細胞代謝、神經性肌肉組織發展與成長(特別是在出生胎兒的腦部)[24]。缺碘症[25][26]是造成可避免性腦損害疾病最常見的因素,全世界估計有五千萬人深受影響。
砈和鿬沒有生物學功能。雖然依元素週期律,鹵素越往下越低毒,砈和鿬會比氟、氯、溴、碘低毒,但其極強放射可能引發輻射中毒,砈和鿬極可能有毒,但只會出現在受管制的輻射區域,絕大多數人不可能攝入砈和鿬(除非是在核電廠附近,某些鈾同位素衰變會產生砈)。
注解
- 為了簡潔,用惰性氣體標記法表示核外電子排布:先寫之前的惰性氣體元素符號,再寫該元素外的電子排布。
参考文献
- Haire, Richard G. . Morss; Edelstein, Norman M.; Fuger, Jean (编). 3rd. Dordrecht, The Netherlands: Springer Science+Business Media. 2006: 1724, 1728. ISBN 1-4020-3555-1.
- Emsley, John. . 2011. ISBN 978-0199605637.
- Schweigger, J.S.C. [Postscript of the editor concerning the new nomenclature]. Journal für Chemie und Physik. 1811, 3 (2): 249–255 [2020-11-01]. (原始内容存档于2020-04-23) (德语). On p. 251, Schweigger proposed the word "halogen": "Man sage dafür lieber mit richter Wortbildung Halogen (da schon in der Mineralogie durch Werner's Halit-Geschlecht dieses Wort nicht fremd ist) von αλς Salz und dem alten γενειν (dorisch γενεν) zeugen." (One should say instead, with proper morphology, "halogen" (this word is not strange since [it's] already in mineralogy via Werner's "halite" species) from αλς [als] "salt" and the old γενειν [genein] (Doric γενεν) "to beget".)
- In 1826, Berzelius coined the terms Saltbildare (salt-formers) and Corpora Halogenia (salt-making substances) for the elements chlorine, iodine, and fluorine. See: Berzelius, Jacob. [Annual Report on Progress in Physics and Chemistry] 6. Stockholm, Sweden: P.A. Norstedt & Söner. 1826: 187 [2020-11-01]. (原始内容存档于2020-04-23) (瑞典语). From p. 187: "De förre af dessa, d. ä. de electronegativa, dela sig i tre klasser: 1) den första innehåller kroppar, som förenade med de electropositiva, omedelbart frambringa salter, hvilka jag derför kallar Saltbildare (Corpora Halogenia). Desse utgöras af chlor, iod och fluor *)." (The first of them [i.e., elements], the electronegative [ones], are divided into three classes: 1) The first includes substances which, [when] united with electropositive [elements], immediately produce salts, and which I therefore name "salt-formers" (salt-producing substances). These are chlorine, iodine, and fluorine *).)
- The word "halogen" appeared in English as early as 1832 (or earlier). See, for example: Berzelius, J.J. with A.D. Bache, trans., (1832) "An essay on chemical nomenclature, prefixed to the treatise on chemistry," (页面存档备份,存于) The American Journal of Science and Arts, 22: 248–276 ; see, for example p. 263. (页面存档备份,存于)
- . IUPAC. 2016-11-30 [2016-11-30]. (原始内容存档于2018-07-29).
- 北京师范大学、华中师范大学、南京师范大学无机化学教研室。无机化学(第四版)。北京:高等教育出版社。第454页.
- Hollerman, Arnold. . Berlin: Academic Press. 2001: 423 [2019-12-21]. ISBN 0123526515. (原始内容存档于2013-12-26).
- Bonchev, Danail; Kamenska, Verginia. . The Journal of Physical Chemistry (ACS Publications). 1981, 85 (9): 1177–86 [2019-10-10]. doi:10.1021/j150609a021. (原始内容存档于2013-12-20).
- Bonchev, Danail; Kamenska, Verginia. . J. Phys. Chem. 1981, 85: 1177–1186.
- . www.thoughtco.com. [November 12, 2021]. (原始内容存档于2023-07-09).
- Fairbrother, Peter, "Re: Is hydroastitic acid possible?" (页面存档备份,存于), accessed July 3, 2009.
- 《无机化学》丛书。第六卷.2.6.4卤素含氧酸及其盐.P
- Jaccaud et al. 2000,第392頁.
- Jaccaud et al. 2000,第382頁.
- Villalba, Ayres & Schroder 2008.
- Aigueperse et al. 2000,第430頁.
- Jaccaud et al. 2000,第391–392頁.
- El-Kareh 1994,第317頁.
- Arana et al. 2007.
- Vértes, Attila; Nagy, Sándor; Klencsár, Zoltán. 4. Springer. 2003: 337 [2019-11-09]. ISBN 978-1-4020-1316-4. (原始内容存档于2014-01-08).
- Nielsen 2009.
- Olivares & Uauy 2004.
- Gropper SS, Groff JL, et al.(2005)Advanced Nutrition and Human Metabolism, 4th ed., pp. 468-473. Wardswirth, ISBN 978-0-534-55986-1
- . [2018-11-12]. (原始内容存档于2012-10-18).
- (页面存档备份,存于)


.png.webp)