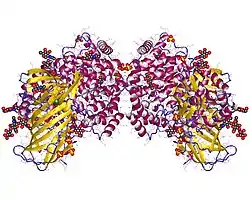
丙氨酸氨肽酶
丙胺酸胺肽酶(EC 3.4.11.2;簡稱AAP、AP-N,又稱CD13)是由ANPEP基因(在人類基因組中位於15號染色體)編碼的一個第二型整合蛋白,為一金屬蛋白酶[5]。此蛋白可分解蛋白質N端除脯胺酸以外的胺基酸,在小腸微絨毛細胞中可完成蛋白質分解的最後步驟,此外在巨噬細胞、樹突細胞等免疫細胞中此蛋白還有許多功能,參與許多訊息傳遞途徑,包括將荷爾蒙、細胞激素和趨化因子等多肽N端的胺基酸切除以調控其活性,以及一些與其蛋白酶活性無關的功能,如與受體結合或本身作為受體等。
化學性質
不同物種的丙胺酸胺肽酶大小介於140kDa與160kDa之間,其上有許多醣基修飾,有超過20%的質量為醣類。此蛋白等電點約為5[6],可分為I至VII等7個結構域,結構域I位於其N端,位於細胞質側,僅由7個胺基酸組成,具有蛋白酶活性的部分位於結構域V與VI之間,兩個蛋白的結構域VII可相互結合而形成二聚體,一般此蛋白都是以二聚體的形式存在於細胞膜上,但也有部分被細胞釋放到血液中,稱為sCD13(s代表「可溶解」),可能是膜上的丙胺酸胺肽酶被其他蛋白酶切割而脫離細胞所產生[7][8]。
功能
丙胺酸胺肽酶位於小腸微絨毛的細胞膜上,將已被胃蛋白酶、胰蛋白酶部分分解的蛋白質進一步分解,從N端將胺基酸水解(但無法水解脯胺酸),完成蛋白質分解的最後步驟。除小腸外,腎臟的上皮細胞[9],以及單核球、巨噬細胞、嗜中性球、肥大細胞、樹突細胞與活化的淋巴球等免疫細胞也有表現丙胺酸胺肽酶[5]。
切割多肽
除在小腸分解食糜中的蛋白質外,丙胺酸胺肽酶還可藉由移除荷爾蒙、細胞激素和趨化因子等多肽N端的胺基酸調控其活性,例如促進發炎反應的激肽被切割後活性即大幅降低;促進吞噬作用的促吞噬肽被切割後雖失去作用,但仍可與完整的多肽競爭受體,成為其拮抗劑;促進發炎反應的CXCL11被切割後也可抑制其原本的功能[5]。此外丙胺酸胺肽酶還可切割脑啡肽以將其分解,以及將血管收縮素IIIN端的離胺酸切除,將其轉為血管收縮素IV以降低其活性[8]。
調節免疫
免疫細胞中的丙胺酸胺肽酶還有些與其蛋白酶活性無關的功能,包括促進吞噬作用、與其他受體結合以參與訊息傳遞、或本身即作為訊息傳遞的受體[5][10]。丙胺酸胺肽酶可活化單核球與巨噬細胞等吞噬細胞,γ-干擾素、脂多糖、C5a、IL-4和TGF-β均可增加吞噬細胞中丙胺酸胺基肽酶的表現,膜上的丙胺酸胺基肽酶被其他蛋白酶切割後可脫離細胞,形成sCD13,後者可與吞噬細胞的G蛋白偶聯受體結合以啟動許多下游的訊息傳遞路徑,活化免疫反應,另外丙胺酸胺肽酶還可與這兩種細胞膜上的FcγR受體互動,促進吞噬作用進行;樹突細胞中的丙胺酸胺肽酶可協助分解和MHC結合、抗原呈現於細胞表面的多肽;嗜中性球中的丙胺酸胺肽酶可能影響其遷移,並抑制其凋亡[5]。
病毒受體
許多冠狀病毒以丙胺酸胺肽酶為受體感染細胞,包括人類冠狀病毒229E、豬傳染性胃腸炎病毒、豬流行性腹瀉病毒[11]、豬丁型冠狀病毒[12]、貓冠狀病毒、犬冠狀病毒[13]等。另外還有研究顯示丙胺酸胺肽酶是巨細胞病毒感染人類細胞所使用的受體之一[8]。
研究歷史
1952年,有科學家發現從豬腎臟純化的RNA樣本有切割半胱胺酸-甘胺酸雙肽的雙肽酶的功能,將其命名為半胱胺酸-甘胺酸酶(cysteinyl-glycinase),認為此RNA有切割蛋白質的活性。1957年有研究闡明此酵素實為純化過程中未能移除的蛋白質,而非RNA[14]。早期此蛋白因最早從豬腎臟分離的過程出現在微粒體(microsome)樣本中而被稱為胺肽酶M(aminopeptidase M,M代表微粒體),1980年此蛋白重新被命名為胺肽酶N,因其較易分解中性的氨基酸而得名(N代表中性),其中尤以分解丙氨酸的效率最高[6]。
參考文獻
- GRCh38: Ensembl release 89: ENSG00000166825 - Ensembl, May 2017
- GRCm38: Ensembl release 89: ENSMUSG00000039062 - Ensembl, May 2017
- . National Center for Biotechnology Information, U.S. National Library of Medicine.
- . National Center for Biotechnology Information, U.S. National Library of Medicine.
- Lu C, Amin MA, Fox DA. . J Immunol. 2020, 204 (1): 3–11. PMC 6997018
 . PMID 31848300. doi:10.4049/jimmunol.1900868.
. PMID 31848300. doi:10.4049/jimmunol.1900868. - Turner, Anthony J. : 289–294. 2004. doi:10.1016/B978-0-12-079611-3.50077-X.
- Morgan RL, Behbahani-Nejad N, Endres J, Amin MA, Lepore NJ, Du Y; et al. . PLoS One. 2016, 11 (9): e0162008. PMC 5033571
 . PMID 27658265. doi:10.1371/journal.pone.0162008.
. PMID 27658265. doi:10.1371/journal.pone.0162008. - Mina-Osorio P. . Trends Mol Med. 2008, 14 (8): 361–71. PMC 7106361
 . PMID 18603472. doi:10.1016/j.molmed.2008.06.003.
. PMID 18603472. doi:10.1016/j.molmed.2008.06.003. - . NCBI. 2021-02-03 [2021-02-19]. (原始内容存档于2019-09-25).
- Nefla M, Sudre L, Denat G, Priam S, Andre-Leroux G, Berenbaum F; et al. . J Cell Sci. 2015, 128 (17): 3250–62. PMC 4582189
 . PMID 26208633. doi:10.1242/jcs.169573.
. PMID 26208633. doi:10.1242/jcs.169573. - Li BX, Ge JW, Li YJ. . Virology. 2007, 365 (1): 166–72. PMC 7103304
 . PMID 17467767. doi:10.1016/j.virol.2007.03.031.
. PMID 17467767. doi:10.1016/j.virol.2007.03.031. - Li W, Hulswit RJG, Kenney SP, Widjaja I, Jung K, Alhamo MA; et al. . Proc Natl Acad Sci U S A. 2018, 115 (22): E5135–E5143. PMC 5984533
 . PMID 29760102. doi:10.1073/pnas.1802879115.
. PMID 29760102. doi:10.1073/pnas.1802879115. - Millet JK, Jaimes JA, Whittaker GR. . FEMS Microbiol Rev. 2020. PMC 7665467
 . PMID 33118022. doi:10.1093/femsre/fuaa057.
. PMID 33118022. doi:10.1093/femsre/fuaa057. - SEMENZA G. . Biochim Biophys Acta. 1957, 24 (2): 401–13. PMID 13436444. doi:10.1016/0006-3002(57)90212-3.
外部連結
- The MEROPS online database for peptidases and their inhibitors: M01.001 (页面存档备份,存于)
- 醫學主題詞表(MeSH):CD13+Antigens
- Human ANPEP genome location and ANPEP gene details page in the UCSC Genome Browser.