草酸
草酸(英語:),也称酢浆草酸,IUPAC系統名為乙二酸,化學式為HO
2C–CO
2H。它是最简单的二羧酸。它是一种白色结晶固体,溶于水中形成无色溶液。它的名字来源于早期研究人员从酢浆草属的开花植物中分离,通常为酢浆草。它天然存在于许多食物中,但过量摄入草酸或长时间皮肤接触可能是危险的。
| 草酸 | |||
|---|---|---|---|
 | |||
| |||
 | |||
| IUPAC名 Oxalic acid[1] | |||
| 系统名 Ethanedioic acid[1] 乙二酸 | |||
| 别名 | 酢浆草酸 | ||
| 识别 | |||
| CAS号 | 144-62-7(无水) 6153-56-6(二水) | ||
| PubChem | 971 | ||
| ChemSpider | 946 | ||
| SMILES |
| ||
| Beilstein | 385686 | ||
| Gmelin | 2208 | ||
| 3DMet | B00059 | ||
| UN编号 | 3261 | ||
| EINECS | 205-634-3 | ||
| ChEBI | 16995 | ||
| RTECS | RO2450000 | ||
| DrugBank | DB03902 | ||
| KEGG | C00209 | ||
| MeSH | Oxalic+acid | ||
| 性质 | |||
| 化学式 | H2C2O4(无水) C2H2O4·2H2O(二水) | ||
| (无水)90.03 g/mol (二水)126.07 g·mol⁻¹ | |||
| 外观 | 白色晶体 | ||
| 密度 | 1.90 g/cm³(无水) 1.653 g/cm³(二水) | ||
| 熔点 | 101-102 °C(二水) | ||
| 溶解性(水) | 9.5 g/100 mL(15 °C) 14.3 g /100 mL(25 °C?) 120 g/100 mL(100 °C) | ||
| pKa1 | 1.38 | ||
| pKa2 | 4.28 | ||
| 热力学 | |||
| S⦵298K | 109.8 J·mol−1·K−1 | ||
| 热容 | 91.0 J·mol−1·K−1 | ||
| 危险性 | |||
GHS危险性符号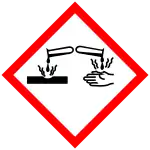  | |||
| H-术语 | H302+312, H318, H402 | ||
| P-术语 | P264, P270, P273, P280, P302+352+312, P305+351+338+310, P362+364, P501 | ||
| 主要危害 | 腐蚀性 | ||
| NFPA 704 |
 1
3
0
| ||
| PEL | TWA 1 mg/m3[2] | ||
| 致死量或浓度: | |||
LDLo(最低) |
1000 mg/kg(犬,口服) 1400 mg/kg(大鼠) 7500 mg/kg(大鼠,口服)[3] | ||
| 相关物质 | |||
| 相关化学品 | |||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
草酸的酸性比乙酸强得多,同时它是一种还原剂[4]。其共軛鹼稱為草酸盐(C
2O2−
4),是一种金属阳离子的螯合剂。草酸一般以二水合物(C
2H
2O
4 · 2H2O)的形式存在。
製備
草酸主要是在五氧化二钒的存在下,用硝酸或空气将碳水化合物或葡萄糖氧化制得。可以使用多种前体,包括乙醇酸和乙二醇。[5]一种较新的方法需要对醇进行氧化羰基化以产生草酸二酯:
这些草酸二酯随后水解成草酸。每年大约生产120000吨。[6]
历史上,草酸仅通过对木糠使用苛性碱(如氢氧化钠或氢氧化钾),然后用无机酸(例如硫酸)酸化草酸盐来获得。[7]草酸也可以通过在碱性催化剂存在下加热甲酸钠形成。[8]
结构
无水物
无水草酸有两种多形体;其中一种的氢键形成了链状结构,而另一种形式的氢键模式则确定了片状结构。[12]由于无水材料既是酸性又是亲水性的(寻求水),因此可用于酯化反应。
化学性质
酸碱性
文献中草酸的pKa值在1.25–1.46和3.81–4.40之间变化。[16][17][18] 2019年发布的第100版CRC的值为1.25和3.81。[19] 与其他羧酸相比,草酸相对强:
草酸会发生许多其他羧酸所特有的反应。它会形成酯类,如草酸二甲酯(熔点52.5-53.5°C)[20]它会形成一种称为草酰氯的酸性氯化物。
产生
存在于食物和植物中

早期的研究人员从酢浆草()中分离出草酸。菠菜科和芸薹属植物(卷心菜、西兰花、球芽甘蓝等),以及酢浆草科和伞形科植物(如欧芹)的草酸盐含量很高。[25]藜属和苋科相关属的所有物种的叶子和茎都含有高水平的草酸,其中包括藜麦。[26]大黄叶含约0.5%的草酸,天南星(Arisaema triphyllum)含有草酸钙晶体。同样,五叶地锦是一种常见的装饰性藤本植物,在其浆果中会产生草酸,并在树液中以针晶的形式产生草酸晶体。细菌通过碳水化合物的氧化产生草酸盐。[6]
窗玉属植物会产生由结晶草酸制成的光导纤维,用于将光传输到地下光合作用场所。[27]
杨桃也含有草酸和杨桃毒素。柑橘汁含有少量的草酸。有机农业生产的柑橘类水果比传统农业生产的水果含有较少的草酸。[28]
在某些石灰石和大理石雕像和纪念碑上形成的天然草酸钙斑,被认为是由碳酸盐石头与地衣或其他微生物分泌的草酸发生化学反应造成的。[29][30]
生物化学
草酸的共轭碱是草酸氢根阴离子,其共轭碱(草酸盐)是乳酸脱氢酶(LDH)的竞争性抑制剂。[35]LDH催化丙酮酸转化为乳酸(发酵(厌氧)过程的最终产品),同时将辅酶NADH氧化为NAD+和H+。恢复NAD+水平对继续通过糖酵解进行无氧能量代谢至关重要。由于癌细胞优先使用无氧代谢(见瓦氏效應),抑制LDH已被证明可以抑制肿瘤的形成和生长,[36]因此是癌症治疗的一个有趣的潜在过程。
草酸在病原真菌和植物之间的互动中起着关键作用。少量的草酸可以增强植物对真菌的抵抗力,但较高的草酸会导致植物广泛的程序性细胞死亡并有助于真菌感染。植物通常会产生少量的草酸,但一些病原真菌,如核盘菌(Sclerotinia sclerotiorum)会造成有毒的积累。[37]
草酸盐除了被生物合成外,也可以被生物降解。产甲酸草酸杆菌(Oxalobacter formigenes)是一种重要的肠道细菌,可以帮助动物(包括人类)降解草酸盐。[38]
用途
草酸的主要应用包括清洁或漂白,尤其是除锈(铁的络合剂)。它在除锈剂中的用途是由于它与铁离子形成稳定的水溶性盐,即三草酸合铁离子。草酸是一些牙齿美白产品的成分。生产的草酸中约有25%将用作染色过程中的媒染剂。它还用于纸浆用木材的漂白剂,铁锈污染消除剂,发酵粉[6]和作为硅分析仪器的第三种试剂。

草酸稀溶液(0.05–0.15M)可用于从粘土(如高岭石)中去除铁,以生产浅色陶瓷器。[40]
草酸有时被用于铝阳极氧化工艺中,可以使用或不使用硫酸。[43]与硫酸阳极氧化相比,获得的涂层更薄,表面粗糙度更低。
毒性
草酸的LD50約為375mg/kg(以大鼠計),[45]口服的LDLo約為600mg/kg。[46][47]草酸的毒性是由于固体草酸钙沉淀引起的肾功能衰竭。[48]
已知草酸盐会导致线粒体功能障碍。[49]
摄入乙二醇会代谢出草酸,也可导致急性肾功能衰竭。
參考資料
- . . Cambridge: The Royal Society of Chemistry. 2014: P001–P004. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
- NIOSH Pocket Guide to Chemical Hazards. . NIOSH.
- . Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- . Wiley. 2005: 17624/28029. ISBN 9783527306732. doi:10.1002/14356007.
- Eiichi, Yonemitsu; Tomiya, Isshiki; Tsuyoshi, Suzuki and Yukio, Yashima "Process for the production of oxalic acid", 美國專利第3,678,107号, priority date March 15, 1969
- Wilhelm Riemenschneider, Minoru Tanifuji "Oxalic acid" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi: 10.1002/14356007.a18_247.
- Von Wagner, Rudolf. . New York: D. Appleton & Co. 1897: 499 [2022-08-31]. (原始内容存档于2022-10-20).
- . [2022-08-31]. (原始内容存档于2022-11-22).
- Practical Organic Chemistry by Julius B. Cohen, 1930 ed. preparation #42
- Clarke H. T.;. Davis, A. W. (1941). "Oxalic acid (anhydrous)". Org. Synth.: 421; Coll. Vol. 1.
- Bouwman, Elisabeth; Angamuthu, Raja; Byers, Philip; Lutz, Martin; Spek, Anthony L. . Science. July 15, 2010, 327 (5393): 313–315. Bibcode:2010Sci...327..313A. CiteSeerX 10.1.1.1009.2076
 . PMID 20075248. S2CID 24938351. doi:10.1126/science.1177981.
. PMID 20075248. S2CID 24938351. doi:10.1126/science.1177981. - Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- T. M. Sabine, G. W. Cox and B. M. Craven (1969): "A neutron diffraction study of [alpha]-oxalic acid dihydrate" Acta Crystallographica Section B, volume B25, pages 2437-2441. doi:10.1107/S0567740869005905
- F. R. Ahmed and D. W. J. Cruickshank (1953): "A refinement of the crystal structure analyses of oxalic acid dihydrate". Acta Crystallographica volume 6, pages 385-392. doi:10.1107/S0365110X53001083
- Francisco Colmenero (2019): "Negative area compressibility in oxalic acid dihydrate". Materials Letters, volume 245, pages 25-28. doi:10.1016/j.matlet.2019.02.077
- Bjerrum, J., et al. (1958) Stability Constants, Chemical Society, London.
- Haynes, W. M. (Ed.). (2014). CRC Handbook of Chemistry and Physics, 95th Edition (95 edition). Boca Raton; London; New York: CRC Press.
- Clayton, G. D. and Clayton, F. E. (eds.). Patty's Industrial Hygiene and Toxicology, Volume 2A, 2B, 2C: Toxicology. 3rd ed. New York: John Wiley Sons, 1981–1982., p. 4936
- Rumble, J. (Ed.). (2019). CRC Handbook of Chemistry and Physics, 100th Edition (100 edition). CRC Press.
- Bowden, E. (1943). "Methyl oxalate". Org. Synth.: 414; Coll. Vol. 2.
- DezhiQi. . . 2018: 1-185. ISBN 9780128139202. doi:10.1016/B978-0-12-813920-2.00001-5.
- James Higgins, Xuefeng Zhou, Ruifeng Liu, and Thomas T.-S. Huang (1997): "Theoretical Study of Thermal Decomposition Mechanism of Oxalic Acid" Journal of Physical Chemistry A, volume 101, issue 14, pages 2702–2708. doi:10.1021/jp9638191
- S. Harkema, J. W. Bats, A. M. Weyenberg and D. Feil (1972) "The crystal structure of urea oxalic acid (2:1)". Acta Crystallographica Section B, volume B28, pages 1646-1648. doi:10.1107/S0567740872004789
- Dutton, M. V.; Evans, C. S. . Canadian Journal of Microbiology. 1996, 42 (9): 881–895. doi:10.1139/m96-114..
- Rombauer, Rombauer Becker, and Becker (1931/1997). Joy of Cooking, p.415. ISBN 0-684-81870-1.
- Siener, Roswitha; Honow, Ruth; Seidler, Ana; Voss, Susanne; Hesse, Albrecht. . Food Chemistry. 2006, 98 (2): 220–224. doi:10.1016/j.foodchem.2005.05.059.
- Attenborough, David. "Surviving." The Private Life of Plants: A Natural History of Plant Behaviour. Princeton, NJ: Princeton UP, 1995. 265+. "OpenLibrary.org: The Private Life of Plants" (页面存档备份,存于) Print.
- Duarte, A.; Caixeirinho, D.; Miguel, M.; Sustelo, V.; Nunes, C.; Fernandes, M.; Marreiros, A. . Acta Horticulturae. 2012, 933 (933): 601–606. doi:10.17660/ActaHortic.2012.933.78. hdl:10400.1/2790
 .
. - Sabbioni, Cristina; Zappia, Giuseppe. . Aerobiologia. 2016, 7: 31–37. S2CID 85017563. doi:10.1007/BF02450015.
- Frank-Kamemetskaya, Olga; Rusakov, Alexey; Barinova, Ekaterina; Zelenskaya, Marina; Vlasov, Dmitrij. . . 2012: 213–220. ISBN 978-3-642-27681-1. doi:10.1007/978-3-642-27682-8_27.
- Dutton, Martin V.; Evans, Christine S. . Canadian Journal of Microbiology. 1 September 1996, 42 (9): 881–895. doi:10.1139/m96-114.
- Gadd, Geoffrey M. . Advances in Microbial Physiology (Academic Press). 1 January 1999, 41: 47–92. ISBN 9780120277414. PMID 10500844. doi:10.1016/S0065-2911(08)60165-4 (英语).
- Hermann Strasser, Wolfgang Burgstaller, Franz Schinner(1994): "High-yield production of oxalic acid for metal leaching processes by Aspergillus niger". FEMS Microbiology Letters, volume 119, issue 3, pages 365–370. doi:10.1111/j.1574-6968.1994.tb06914.x
- Jan S. Tkacz, Lene Lange (2012): Advances in Fungal Biotechnology for Industry, Agriculture, and Medicine. 445 pages. ISBN 9781441988591
- Novoa, William; Alfred Winer; Andrew Glaid; George Schwert. . Journal of Biological Chemistry. 1958, 234 (5): 1143–8. PMID 13654335. doi:10.1016/S0021-9258(18)98146-9
 .
. - Le, Anne; Charles Cooper; Arvin Gouw; Ramani Dinavahi; Anirban Maitra; Lorraine Deck; Robert Royer; David Vander Jagt; Gregg Semenza; Chi Dang. . Proceedings of the National Academy of Sciences. 14 December 2009, 107 (5): 2037–2042. PMC 2836706
 . PMID 20133848. doi:10.1073/pnas.0914433107
. PMID 20133848. doi:10.1073/pnas.0914433107  .
. - Lehner, A; Meimoun, P; Errakhi, R; Madiona, K; Barakate, M; Bouteau, F. . Plant Signaling & Behavior. September 2008, 3 (9): 746–8. PMC 2634576
 . PMID 19704845. doi:10.4161/psb.3.9.6634.
. PMID 19704845. doi:10.4161/psb.3.9.6634. - Daniel SL, Moradi L, Paiste H, Wood KD, Assimos DG, Holmes RP, et al. Julia Pettinari M , 编. . Applied and Environmental Microbiology. August 2021, 87 (18): e0054421. Bibcode:2021ApEnM..87E.544D. PMC 8388816
 . PMID 34190610. doi:10.1128/AEM.00544-21.
. PMID 34190610. doi:10.1128/AEM.00544-21. - Yu-Lun Lisa Fu. . Michigan State University. 2008.
- Sung Oh Lee, Tam Tran, Byoung Hi Jung, Seong Jun Kim, and Myong Jun Kim (2007): "Dissolution of iron oxide using oxalic acid". Hydrometallurgy, volume 87, issues 3–4. pages 91-99. doi:10.1016/j.hydromet.2007.02.005
- Jackson, Faith. "Quartz Crystal Cleaning" 的存檔,存档日期2013-10-29.. bluemooncrystals.com
- "Rock Currier – Cleaning Quartz" (页面存档备份,存于). mindat.org
- Keshavarz, A., Parang, Z. & Nasseri, A. The effect of sulfuric acid, oxalic acid, and their combination on the size and regularity of the porous alumina by anodization. J Nanostruct Chem 3, 34 (2013). https://doi.org/10.1186/2193-8865-3-34
- Lowalekar, Viral Pradeep. . UA Campus Repository (University of Arizona). 2006 [2022-08-31]. Bibcode:2006PhDT........96L. (原始内容存档于2021-07-29) (英语).
- . [2010-01-12]. (原始内容存档于2008-10-16).
- (PDF). Radiant Indus Chem. [2014-05-20]. (原始内容 (PDF)存档于2014-05-20).
- Safety Officer in Physical Chemistry. . 牛津大學出版社. 2005-08-13 [2009-12-03]. (原始内容存档于2010-01-07).
- EMEA Committee for veterinary medicinal products, oxalic acid summary report, December 2003
- Patel, Mikita; Yarlagadda, Vidhush; Adedoyin, Oreoluwa; Saini, Vikram; Assimos, Dean G.; Holmes, Ross P.; Mitchell, Tanecia. . Redox Biology. May 2018, 15: 207–215. PMC 5975227
 . PMID 29272854. doi:10.1016/j.redox.2017.12.003.
. PMID 29272854. doi:10.1016/j.redox.2017.12.003. - Rajagopal, G.; Toora, B. D.; Sivakamasundari, R. I. . Biomedicine. 10 August 2004, 24 (3–4): 32–35.
外部链接
| 维基共享资源中相关的多媒体资源:草酸 |
- Oxalic acid MS Spectrum(页面存档备份,存于)
- 国际化学品安全卡0529
- NIOSH Guide to Chemical Hazards (CDC)(页面存档备份,存于)
- Table: Oxalic acid content of selected vegetables (USDA)
- Alternative link: Table: Oxalic Acid Content of Selected Vegetables (USDA)(页面存档备份,存于)
- About rhubarb poisoning (The Rhubarb Compendium)
- Oxalosis & Hyperoxaluria Foundation (OHF) The Oxalate Content of Food 2008 (PDF)
- Oxalosis & Hyperoxaluria Foundation (OHF) Diet Information
- Calculator: Water and solute activities in aqueous oxalic acid(页面存档备份,存于)