光系统 II
光系统II (或水 - 质体醌氧化还原酶 )是氧光合作用的光依赖性反应中的第一个蛋白质复合物。它位于植物、藻类和蓝细菌的类囊体膜中。 在光系统中,酶捕获光的光子以激发电子,然后通过各种辅酶和辅因子转移电子以将质体醌还原为质体酚。 激发的电子氧化水而被取代,形成氢离子和分子氧。
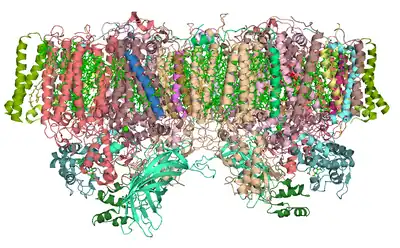
通过光解水得到的电子来补充丢失的电子,光系统 II为所有光合作用提供电子。由水的氧化产生的氢离子(质子)有助于产生质子梯度, ATP合成酶用于产生ATP。转移到质体醌的赋能电子最终用于还原NADP+
为NADPH或用于非循环电子流 。 [1]
结构
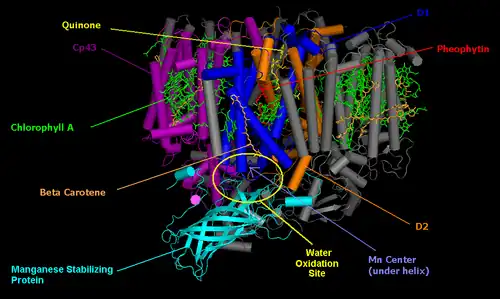
PSII的核心由两个同源蛋白D1和D2的假对称异二聚体组成。[2] 与所有其他光系统的反应中心不同,其中位于叶绿素二聚体上的最开始的光诱导分离的正电荷由两种单体平均分配,在完整的PSII中,电荷主要位于一个叶绿素中心(70-80%)。 [3] 因此,P680+具有高度氧化性,可以参与水的分解。 [2]
光系统II( 蓝细菌和绿色植物)由大约20个亚基(取决于生物体)以及其他附属的光捕获蛋白组成。 每个光系统II含有至少99个辅因子:每个单体35个叶绿素a,12个β-胡萝卜素 ,两个脱镁叶绿素 ,两个质体醌 ,两个血红素,一个碳酸氢盐,20个脂质, Mn
4CaO
5簇(包括两个氯离子),一个非血红素Fe2+
和两个推定的Ca2+
离子。[4] 光系统II有几种晶体结构。[5] 在PDB中此蛋白的登录码是3WU2 , 3BZ1,3BZ2 (3BZ1和3BZ2是光系统II二聚体的单体结构), [4] 2AXT , 1S5L , 1W5C , 1ILX , 1FE1, 1IZL 。
| 亚基 | 种类 | 功能 |
|---|---|---|
| D1 | 光合反应中心蛋白 | 反应中心蛋白,结合叶绿素P680,脱镁叶绿素,β-胡萝卜素,醌和锰中心 |
| D2 | 反应中心蛋白质 | |
| CP43 | 光系统II捕光蛋白 | 结合锰中心 |
| CP47 | ||
| PsbO | 锰稳定蛋白 ( IPR002628 ) | 锰稳定蛋白质 |
| 辅 | 功能 |
|---|---|
| 叶绿素 | 吸收光能并将其转化为化学能 |
| Β-胡萝卜素 | 淬灭过量的光激发能量 |
| 血红素B559 | 与细胞色素b559结合作为次级/保护性电子载体 |
| 脱镁叶绿素 | 初级电子受体 |
| 体醌 | 移动式内部类囊膜电子载体 |
| 锰中心 | 也被称为放氧中心,或OEC |
| Photosystem II | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| 识别码 | |||||||
| EC編號 | 1.10.3.9 | ||||||
| 数据库 | |||||||
| IntEnz | IntEnz浏览 | ||||||
| BRENDA | BRENDA入口 | ||||||
| ExPASy | NiceZyme浏览 | ||||||
| KEGG | KEGG入口 | ||||||
| MetaCyc | 代谢路径 | ||||||
| PRIAM | 概述 | ||||||
| PDB | RCSB PDB PDBj PDBe PDBsum | ||||||
| |||||||
放氧复合物(OEC)
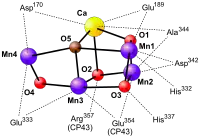
放氧复合物是水氧化的部位。它是一种金属-氧代簇,包含四个锰离子(氧化态为+2至+4) [6]和一个二价钙离子。当它氧化水,产生氧气和质子时,它依次将四个电子从水中输送到酪氨酸(D1-Y161)侧链,然后输送到P680本身。放氧复合物的第一个结构模型是用冷冻蛋白质晶体的X射线晶体学研究解决的,2001年的分辨率为3.8埃 。 [7] 在接下来的几年中,模型的分辨率逐渐增加到2.9Å 。 [8] [9] [10] 虽然获得这些结构本身就是一项伟大的壮举,但他们没有详细展示放氧复合物。 2011年,PSII的OEC被解析至1.9Å,显示出五个氧原子作为连接五个金属原子和四个与Mn4CaO5簇结合的水分子的氧桥。在每个光系统II单体中发现了超过1,300个水分子,一些形成了广泛的氢键网络,可以作为质子,水或氧分子的通道。[11] 在这个阶段,有人提出通过X射线晶体学获得的结构是有偏差的,因为有证据表明锰原子被所用的高强度X射线还原,改变了观察到的OEC结构。这激励研究人员将他们的晶体带到不同的X射线设备,称为X射线自由电子激光器 ,如美国的SLAC。 2014年,确认了2011年观察到的结构。 [12] 了解光系统 II的结构并不足以揭示它是如何工作的。所以现在已经开始解析在机械循环的不同阶段的光系统 II的结构的竞赛(讨论如下)。 目前,S1状态和S3状态的结构几乎同时从两个不同的组中公布,显示在Mn1和Mn4之间添加了一个氧分子O6,[13] [14]表明这可能是放氧复合物上的位置产生氧气。
水裂解
光合水分解(或氧气释放)是地球上最重要的反应之一,因为它是几乎所有大气氧气的来源。 此外,人工光合水分解可有助于有效利用太阳光作为替代能源。
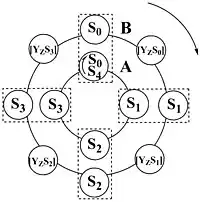
水氧化的机理尚未完全阐明,但我们知道有关这一过程的许多细节。 水氧化成分子氧需要从两个水分子中提取四个电子和四个质子。Pierre Joliot等人提供了通过放氧复合物(OEC)在一个PSII内循环反应释放氧气的实验证据。[15] 他们已经证明,如果适应黑暗的光合物质(高等植物,藻类和蓝细菌)暴露于一系列单独闪光,用典型周期四阻尼振荡检测氧气释放,在第三次和第七次闪光时具有最大值,在第一次和第五次闪光时有最小值(详情[16] )。 基于这个实验,Bessel Kok和同事们[17]引入了一个由所谓的S态引起的五次闪光诱导转变的循环,描述了OEC的四种氧化还原状态:当存储了四种氧化当量时(在S4状态),OEC返回其基本的S0状态。在没有光线的情况下,OEC将“放松”到S1状态; S1状态通常被描述为“暗稳定”。 S1状态主要被认为是由具有Mn3 +、Mn3 + 、Mn 4 + 、Mn 4+氧化态的锰离子组成。 [6] 最后,Jablonsky和Lazar提出了中间S-状态 [18]作为调节机制和S-状态与酪氨酸Z之间的联系。
2012年,Renger表述了在水分解过程中水分子内部变化为不同S态的典型氧化物的意见。[19] 2017年,Dolai通过S态的结构分析和水分子产生的氧化物,展示了几乎完整的水分解概念。 [20]
Dolai的S状态图(Dolai的机制): Dolai的图是在光合作用过程中水分裂中不同S态的图像。 这些图表可以表示中间S-状态的估计数字以及典型氧化物(一氧化物(2H2O)、氢氧化物(OH·H
2O)、过氧化物( H
2O
2 ),超氧化物( HO
2 )和氧2( O
2 ))的产生;这是由于S状态的水分子交换而形成的。氢键的排列是图的主要标准。光子(hv),电子发射(e)和水分子产生氢离子(H +)的影响可以通过图表以更具体的实验检测方式显示。这些图几乎完全分析了光合作用中水分解的途径。
抑制剂
光系统 II的酶抑制剂可用作除草剂。这些抑制剂主要有两类,一类是1,3,5-三嗪的衍生物[21],最常用的为草脱净和西玛津;另一类抑制剂则是含有芳基的脲类,如绿麦隆和二氯苯基二甲脲(DCMU)。[22][23]
参考文献
- . Nature. December 2005, 438 (7070): 1040–4. Bibcode:2005Natur.438.1040L. PMID 16355230. doi:10.1038/nature04224.
- . Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. January 2003, 358 (1429): 245–53. PMC 1693113
 . PMID 12594932. doi:10.1098/rstb.2002.1186.
. PMID 12594932. doi:10.1098/rstb.2002.1186. - . Biochemistry. April 2007, 46 (14): 4390–7. PMID 17371054. doi:10.1021/bi700157n.
- . Nature Structural & Molecular Biology. March 2009, 16 (3): 334–42. PMID 19219048. doi:10.1038/nsmb.1559.
-
Yano, Junko; Kern, Jan; Yachandra, Vittal K.; Nilsson, Håkan; Koroidov, Sergey; Messinger, Johannes. . Metal Ions in Life Sciences 15. Springer. 2015: 13–43. ISBN 978-3-319-12414-8. PMC 4688042
 . PMID 25707465. doi:10.1007/978-3-319-12415-5_2.
. PMID 25707465. doi:10.1007/978-3-319-12415-5_2.
- . Biochemistry. February 2005, 44 (6): 2129–42. PMID 15697239. doi:10.1021/bi048460i.
- . Nature. February 2001, 409 (6821): 739–43. PMID 11217865. doi:10.1038/35055589 (英语).
- . Proceedings of the National Academy of Sciences of the United States of America. January 2003, 100 (1): 98–103. Bibcode:2003PNAS..100...98K. PMC 140893
 . PMID 12518057. doi:10.1073/pnas.0135651100.
. PMID 12518057. doi:10.1073/pnas.0135651100. - . Science. March 2004, 303 (5665): 1831–8 [2019-07-02]. Bibcode:2004Sci...303.1831F. PMID 14764885. doi:10.1126/science.1093087. (原始内容存档于2019-03-19).
- . Nature Structural & Molecular Biology. March 2009, 16 (3): 334–42 [2019-07-02]. PMID 19219048. doi:10.1038/nsmb.1559. (原始内容存档于2022-03-13) (英语).
- (PDF). Nature. May 2011, 473 (7345): 55–60 [2020-09-30]. Bibcode:2011Natur.473...55U. PMID 21499260. doi:10.1038/nature09913. (原始内容存档 (PDF)于2020-07-24).
- . Nature. January 2015, 517 (7532): 99–103 [2019-07-02]. Bibcode:2015Natur.517...99S. PMID 25470056. doi:10.1038/nature13991. (原始内容存档于2022-04-02) (英语).
- . Nature. December 2016, 540 (7633): 453–457 [2019-07-02]. Bibcode:2016Natur.540..453Y. PMC 5201176
 . PMID 27871088. doi:10.1038/nature20161. (原始内容存档于2022-01-21) (英语).
. PMID 27871088. doi:10.1038/nature20161. (原始内容存档于2022-01-21) (英语). - . Nature. March 2017, 543 (7643): 131–135 [2019-07-02]. Bibcode:2017Natur.543..131S. PMID 28219079. doi:10.1038/nature21400. (原始内容存档于2019-11-18) (英语).
- Joliot P.; Barbieri G.; Chabaud R. . Photochemistry and Photobiology. 1969, 10 (5): 309–329. doi:10.1111/j.1751-1097.1969.tb05696.x.
- . Photosynthesis Research. 2003, 76 (1–3): 65–72. PMID 16228566. doi:10.1023/A:1024946610564.
- . Photochemistry and Photobiology. June 1970, 11 (6): 457–75. PMID 5456273. doi:10.1111/j.1751-1097.1970.tb06017.x.
- . Biophysical Journal. April 2008, 94 (7): 2725–36. Bibcode:2008BpJ....94.2725J. PMC 2267143
 . PMID 18178650. doi:10.1529/biophysj.107.122861.
. PMID 18178650. doi:10.1529/biophysj.107.122861. - . Biochimica et Biophysica Acta. August 2012, 1817 (8): 1164–76. PMID 22353626. doi:10.1016/j.bbabio.2012.02.005.
- Dolai, U. . IOSR Journal of Pharmacy and Biological Sciences. 2017, 12 (6): 65–67. ISSN 2319-7676. doi:10.9790/3008-1206026567 (不活跃 2019-01-26).
- . alanwood.net. [2021-03-26]. (原始内容存档于2021-04-20).
- . alanwood.net. [2021-03-26]. (原始内容存档于2021-04-20).
- Oettmeier W. . . 1992: 349–408. ISBN 9780444894403. doi:10.1016/B978-0-444-89440-3.50018-7.