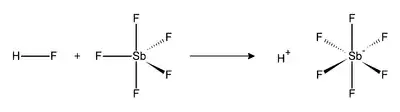
氟銻酸
氟銻酸(化学式:HSbF6)或稱六氟銻酸,是氫氟酸和五氟化銻反應後的產物。[2]以一比一的比例混合时成為現在已知最強的超強酸,實驗證明能分解碳氫化合物,產生碳正離子以及氫氣。[3]
| 氟锑酸 | |
|---|---|
 | |
 | |
| IUPAC名 Fluoroantimonic acid | |
| 系统名 Hydrogen hexafluoro-λ5-stibanuide | |
| 别名 | 六氟銻酸 六氟合锑(V)酸 |
| 识别 | |
| CAS号 | 16950-06-4(无水) 72121-43-8(六水) |
| PubChem | 6337100 |
| ChemSpider | 21241496 |
| SMILES |
|
| EINECS | 241-023-8 |
| 性质 | |
| 化学式 | HSbF6 |
| 236.808(无水) 344.85(六水) g·mol⁻¹ | |
| 外观 | 無色液体(无水物) 无色固体(六水合物)[1] |
| 密度 | 2.885 g/cm3(25℃,无水) |
| 沸点 | 分解 |
| 溶解性(水) | 分解 |
| 溶解性 | 溶於SO2ClF,SO2 |
| pKa | −25 |
| pKb | 39 |
| 危险性 | |
欧盟危险性符号 有毒 T 有毒 T 腐蚀性 C 腐蚀性 C 危害环境N 危害环境N | |
| 警示术语 | R:R39/23/24/25, R35 |
| 安全术语 | S:S1/2, S36/37/39, S45, S53, S60, S61 |
| 主要危害 | 強腐蝕性,劇烈水解 |
| NFPA 704 |
 0
4
4
|
| 闪点 | 不可燃 |
| 相关物质 | |
| 其他阴离子 | HPF6、HAsF6 |
| 其他阳离子 | NaPF6、NaSbF6 |
| 相关化學品 | HF、SbF5 魔酸 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
氫氟酸(HF)和五氟化銻(SbF5)反应强烈放熱。HF會釋放質子H+,然後氟离子F−會與SbF5形成八面體型的SbF6−阴离子。SbF6−是非配位阴离子,親核性和鹼性都很弱。於是質子實際上是「裸露」在溶液中,使得混合物体系呈現極強的酸性,比純硫酸要強2×1019倍,以下是氫氟酸和五氟化銻的反應方程式:
反应
氟锑酸加热到40 °C下分解,生成氟化氢气体和五氟化锑液体。[5]
参考文献
- 氟锑酸MSDS. SigmaAldrich
- Olah, G. A.; Prakash, G. K. S.; Wang, Q.; Li, X. “Hydrogen Fluoride–Antimony(V) Fluoride” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- George Andrew Olah. . John Wiley and Sons. 2001: 100–101. ISBN 0471157430.
- Mootz, D.; Bartmann, K. . Angewandte Chemie, International Edition in English. 1988, 27: 391–392. doi:10.1002/anie.198803911.
- Oelderik, Jan. . Netherlands Patent Application. December 1966,. NL 6508096 A.
- Bickel, A. F.; Gaasbeek, C. J.; Hogeveen, H.; Oelderik, J. M.; Platteeuw, J. C. . Chemical Communications. 1967, 1967: 634–5. doi:10.1039/C19670000634.
- Hogeveen, H.; Bickel, A. F. . Chemical Communications. 1967, 1967: 635–6. doi:10.1039/C19670000635.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.