双原子碘
双原子碘(化学式 I2)是碘元素的存在形式,由两个碘原子组成。在标准情况下,它是紫色固体。双原子碘会直接升华,从固态变成气态。它具有刺激性,必须小心处理。
| 双原子碘 | |
|---|---|
 | |
 | |
| 别名 | 二碘 碘分子 |
| 识别 | |
| CAS号 | 7553-56-2 |
| SMILES |
|
| 性质 | |
| 化学式 | I2 |
| 摩尔质量 | 253.81 g·mol−1 |
| 外观 | 黑色至蓝色或暗紫色晶体,有刺鼻的气味 [1] |
| 密度 | 4.93 g/cm-3 (固态,20 °C)[2] 3.960 g/cm-3 (液态,120 °C) [3]. |
| 熔点 | 113.7 °C[2] |
| 沸点 | 184.4°C[2] |
| 临界点 | 819.0 K[4],11.6 MPa[2] |
| 溶解性(水) | 330 mg·l-1 (25 °C) [2] |
| 溶解性 | 可混溶于氢碘酸和碘化物 苯:140.9 g/L |
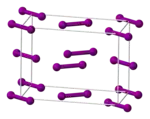
| 结构 | |
| 空间群 | Cmca (No. 64) [6] |
| 危险性 | |
| 警示术语 | R:R50 R20/21 |
| 安全术语 | S:S2 S23 S25 S61 |
GHS危险性符号  [7] [7] | |
| H-术语 | H332, H312, H400 |
| P-术语 | P273, P280 |
| 相关物质 | |
| 相关化学品 | 氟气 氯气 双原子溴 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
反应
和其他卤素一样,双原子碘可以与许多其他元素形成化合物。然而,它的反应性小于较轻的卤素,例如氟气和氯气。双原子碘与氢气反应,形成碘化氢:
双原子碘可以被还原成碘化物,是一种氧化剂,但强度弱于更轻的卤素。(E° = 0.54 V)。双原子碘可以氧化硫化氢,形成硫单质:[8]
被肼还原:
双原子碘和氢氧化物(如:氢氧化钠)反应,歧化成碘化物和次碘酸盐,后者再歧化成碘化物和碘酸盐:[10]
双原子碘在水中的溶解度很差,但在乙醇,氯仿,四氯甲烷和二硫化碳以及碘化钾的水溶液(Lugol溶液)中的可溶。双原子碘在含氧溶剂中的溶液呈棕色;在其他溶剂中的溶液呈紫色或粉红色。通过添加一定量的碘化钾可以增加双原子碘的水溶性,因为形成了易溶的三碘化物:
图片
 |
 |
 |
参考资料
- 国际化学品安全卡7553-56-2
- NLM Hazardous Substances Data Bank entry for , consulté le 5 mai 2010
- O'Neil, Maryadele J.; Smith, Ann; Heckelman, Patricia E.; Budavari, Susan. . Merck (编). . Whitehouse Station (N.J.). 2001: 2564. ISBN 0-911910-13-1 (英语).
- . [12 April 2010]. (原始内容存档于2012-05-19). 已忽略未知参数
|cite=(帮助) - Smith, M. B., Smith, M. B., & Nikonov, G. (2013). Iodine. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289x.ri005.pub3
- . [17 December 2009]. (原始内容存档于2009-04-21). 已忽略未知参数
|site=(帮助) - Numéro index Template:IndexCE dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 December 2008)
- General Chemistry (volume 2) by N.L. Glinka, Mir Publishing 1981
- General Chemistry by Linus Pauling, 1947 ed.
- Advanced Inorganic Chemistry by Cotton and Wilkinson, 2nd ed.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.