甲锗烷
甲锗烷是锗烷(GenH2n+2)中最简单的一种,分子式为GeH4。和同族的甲烷、甲硅烷一样,甲锗烷也是正四面体结构。甲锗烷在空气中燃烧生成二氧化锗和水。
| 甲锗烷 | |||
|---|---|---|---|
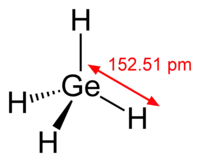 | |||
| |||
| IUPAC名 germane | |||
| 别名 | 四氢化锗 | ||
| 识别 | |||
| CAS号 | 7782-65-2 | ||
| PubChem | 23984 | ||
| ChemSpider | 22420 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | QUZPNFFHZPRKJD-UHFFFAOYAE | ||
| UN编号 | 2192 | ||
| ChEBI | 30443 | ||
| KEGG | C15472 | ||
| 性质 | |||
| 化学式 | GeH4 | ||
| 76.62 g·mol⁻¹ | |||
| 外观 | 无色气体 | ||
| 密度 | (气)3.3 * 103 | ||
| 熔点 | −165 °C (108 K) | ||
| 沸点 | −88 °C (195 K) | ||
| 溶解性(水) | 难溶 | ||
| 结构 | |||
| 分子构型 | 正四面体 | ||
| 偶极矩 | O D | ||
| 危险性 | |||
| 主要危害 | 有毒,可燃 | ||
| NFPA 704 |
 3
4
0
| ||
| 闪点 | 可燃氣體 | ||
| 相关物质 | |||
| 其他阴离子 | 四氯化锗 | ||
| 相关氢化物 | 甲烷、甲硅烷、甲锡烷、铅烷 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
合成
甲锗烷可通过以下方法合成:
- 化学还原法[1]:硼氢化钠、硼氢化钾、硼氢化锂、氢化铝锂、氢化铝钠、氢化锂、氢化钠或氢化镁还原锗、四氯化锗或二氧化锗。这类反应既可在水溶液中进行,也可在有机溶剂中进行。实验室中可通过含氢负离子的化合物与Ge(IV)化合物反应得到,如[2]:
- Na2GeO3 + NaBH4 + H2 → GeH4 + NaBO2 + 2NaOH
用途
甲锗烷在600K时分解为锗和氢气。这种对热不稳定性被用于半导体工业中,即有机金属化学气相沉积法(MOCVD)[4]。由于甲锗烷毒性较大,某些有机锗化合物(如异丁基锗)可以替代甲锗烷,应用于MOCVD中[5]。
参考资料
- US Patent 7,087,102 (2006)
- Girolami, G. S.; Rauchfuss, T. B. and Angelici, R. J., Synthesis and Technique in Inorganic Chemistry, University Science Books: Mill Valley, CA, 1999.
- Kunde, V.; Hanel, R.; Maguire, W.; Gautier, D.; Baluteau, J. P.; Marten, A.; Chedin, A.; Husson, N.; Scott, N. . Astrophysical J. 1982, 263: 443–467. doi:10.1086/160516.
- Venkatasubramanian, R.; Pickett, R. T.; Timmons, M. L. . Journal of Applied Physics. 1989, 66: 5662–5664. doi:10.1063/1.343633.
- E. Woelk, D. V. Shenai-Khatkhate, R. L. DiCarlo, Jr., A. Amamchyan, M. B. Power, B. Lamare, G. Beaudoin, I. Sagnes. . Journal of Crystal Growth. 2006, 287 (2): 684–687 [2008-02-18]. doi:10.1016/j.jcrysgro.2005.10.094. (原始内容存档于2008-05-24).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.