家族性高胆固醇血症
家族性高胆固醇血症(英語:),缩写为FH,是一种遗传性疾病,表现为血液中高胆固醇水平(特别是极高的低密度脂蛋白(LDL)水平)和早期心血管疾病。 由于FH的基本生物化学性质,不同人的情况略有不同,高胆固醇血症患者相对于不患有此症的患者对胆固醇控制手段的反应较不理想(如调整饮食和服用他汀类药物)。然而,治疗(包括提高他汀类药物的剂量)通常是有效的。
| 家族性高胆固醇血症 Familial hypercholesterolemia | |
|---|---|
 | |
| 黄斑瘤眉(黄色瘤),胆固醇沉积导致的眼睑上方的淡黄色斑块,这在FH患者中很常见 | |
| 类型 | familial hyperlipidemia[*]、高膽固醇、疾病 |
| 分类和外部资源 | |
| 醫學專科 | 内分泌学 |
| OMIM | 143890 |
| DiseasesDB | 4707 |
| MedlinePlus | 000392 |
| eMedicine | 121298 |
| Orphanet | 406 |
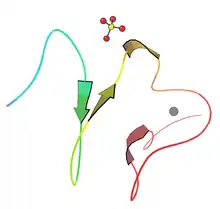
许多人携带突变的LDLR基因,该基因编码LDL受体蛋白质,该蛋白质正常情况下会将LDL从体内循环中清除出去,或LDL中与受体结合的载脂蛋白B(ApoB);其他基因突变的概率很小。携带有杂合子LDLR基因的人可能会在30-40岁时患上早期心血管疾病。携带纯合子的人则会在童年时期便患上严重的心血管疾病。杂合子FH是一种常见的遗传性疾病,通过常染色体显性遗传,在大部分国家发病率为1:500,纯合子FH则罕见许多,几率为1:1,000,000(一百万分之一)。[1]
杂合子FH通常使用他汀类药物、胆汁螯合剂或其他可以降低胆固醇水平的降血脂药来治疗。纯合子FH通常对药物治疗没有反应,并且通常需要使用其他疗法,包括LDL血浆置换法(用类似于透析的方法除去血液中的LDL),有时候也会进行肝移植。[1]
文中的英文缩写
出于阅读的方便,一些专业名词以英文缩写的形式在本文中出现,以下列出释义:
- FH指:家族性高胆固醇血症
- LDL指:低密度脂蛋白
- LDLR指:低密度脂蛋白受体
- ApoB指:载脂蛋白B
- HMG-CoA还原酶指:羟甲基戊二酸单酰辅酶A还原酶
症状
遗传学
FH中最常见的基因缺陷是LDLR的突变(发病率为500人中1人,取决于人口基数)、ApoB的突变(发病率为1000人中1人)、PCSK9的突变(低于2500人中1人)和LDLRAP1的突变。与FH十分相似的疾病sitosterolemia,特征也为脂肪在组织中堆积,其原因是ABCG5和ABCG8的突变。[1]
LDL受体
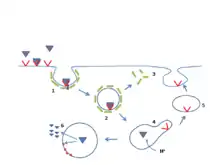

LDL受体基因位于19号染色体的短臂上(19p13.1-13.3)。[5]LDL受体基因包括18个外显子,跨越45个碱基对长度单位,并且其蛋白基因产物包含839个氨基酸。单异常副本(杂合子)FH中40%的患者会在50岁时患上心血管疾病。双异常副本(纯合子)FH患者在童年时便有加速动脉粥样硬化,并且会导致许多并发症。血浆中的LDL水平与LDL受体(LDLR)的活性成负相关。纯合子的LDLR的活性小于2%,而杂合子的LDLR活性在2-25%之间(取决于突变的性质)并伴随LDL代谢缺陷。目前已知有超过1000种不同类型的突变。[1]
根据LDLR突变的性质,FH的类型主要分为以下五种:[6]
病理生理学
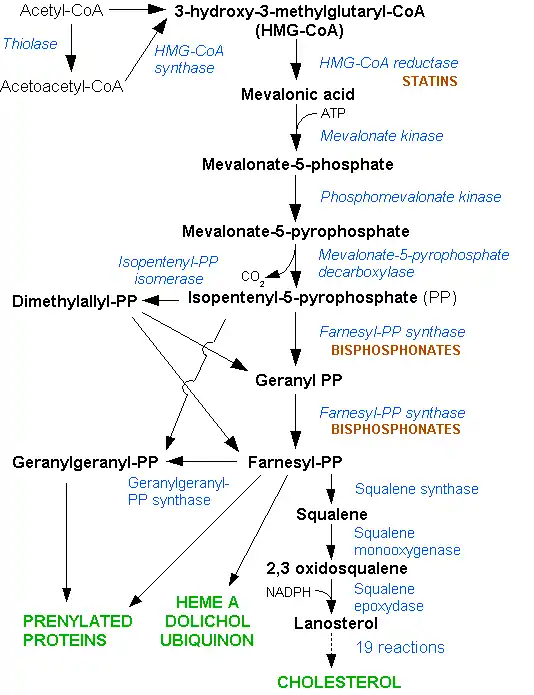
LDL胆固醇通常在体内循环2.5天,然后LDL胆固醇的载脂蛋白B部分会与肝细胞中的LDL受体结合,并开始吸收和消化。 [5]这个过程会将LDL从体内循环中清除。肝脏对胆固醇的合成受HMG-CoA还原酶途径的控制。[8]而FH患者LDL受体的机能减退或消失,[5]并且LDL的平均循环周期会增至4.5天,这导致了血液中LDL胆固醇水平的明显升高,但是脂蛋白水平正常。[3]ApoB突变时,LDL颗粒与受体结合的数量会减少,并导致LDL胆固醇水平的升高。目前尚不清楚PCSK9和ARH的突变如何导致LDL受体的功能障碍。[1]
治疗
杂合子FH
FH通常使用他汀类药物治疗。[5]他汀类药物通过在肝脏内抑制HMG-CoA还原酶来发挥作用,结果是,肝脏会产生更多的LDL受体来清除血液中的LDL。他汀类药物可以有效降低胆固醇和LDL水平,即使有时候需要配合其他药物进行治疗,如胆汁螯合剂(消胆胺或考来替泊)、烟酸制剂或贝特类药物。[1]对其他会导致心血管疾病的风险因素的控制也是必须的,因为有时候即使成功控制住了胆固醇水平,心血管疾病的风险依然会增加。专业指南建议不应该使用通常的风险预测手段来决定病人对他汀类药物的使用(例如源自弗雷明汉心脏研究的结论),因为他们可能低估了心血管疾病发生的风险;不同于其他人,FH患者从出生开始胆固醇一直保持着较高的水平,这也许会增加相关风险。[9]在他汀类药物推出之前,安妥明(一种较老的贝特类药物,经常会导致胆结石)、普罗布考(特别是针对较大的黄色瘤)和甲状腺素曾用来降低LDL胆固醇水平。
存在更大争议的药物是依泽替米贝,其作用为抑制胆对胆固醇的吸收。虽然它减少了LDL胆固醇,但是并没有提高一种叫做内膜中层厚度的动脉粥样硬化的标志。无论这意味着什么,依泽替米贝对FH的整体效果目前还不清楚。[10]
目前尚没有干预性研究直接指出FH患者在胆固醇降低后死亡率也会降低。至少,有多项针对多基因遗传性高胆固醇血症患者(遗传不是主要原因)的试验结果表明,对FH患者进行胆固醇控制是有益的。还有,1999年对大量英国人的观察性研究发现,在他汀类药物发明后,FH患者的死亡率反而提高了。[11]
一项队列研究指出,FH患者使用他汀类药物治疗后可以降低48%因冠状动脉心脏疾病而死亡的几率,结果是FH患者死于冠状动脉心脏疾病的几率不会高于普通人。然而,如果已患上冠状动脉心脏疾病,那么导致死亡的几率会下降25%。这个结果着重强调及早确诊FH并使用他汀类药物进行治疗的重要性。[12]
纯合子FH
纯合子FH的治疗更加困难。
流行病学
全球FH的流行人数约为1000万人。[5]在大部分人口研究中,杂合子FH的发病率约为1:500,但不是所有患者均会表现出症状。[1]纯合子FH的发病率则约为1:1,000,000。[1][3]
LDLR突变在特定人群中很常见,这大概是是因为一种称为「奠基者效应」的遗传现象导致的,这种现象发现于有一人或是数人为突变载体的一小部分人中。南非荷兰人、法国加拿大人、黎巴嫩人、基督教徒和芬兰人的FH致病基因的突变率较高,使得FH在这些人群中格外流行。APOB的突变则更常见于中欧。[1]
引用
- Rader DJ, Cohen J, Hobbs HH. . J. Clin. Invest. 2003, 111 (12): 1795–803. PMC 161432
 . PMID 12813012. doi:10.1172/JCI18925.
. PMID 12813012. doi:10.1172/JCI18925. - Tsouli SG, Kiortsis DN, Argyropoulou MI, Mikhailidis DP, Elisaf MS. . Eur. J. Clin. Invest. 2005, 35 (4): 236–44. PMID 15816992. doi:10.1111/j.1365-2362.2005.01484.x.
- Durrington P. . Lancet. 2003, 362 (9385): 717–31. PMID 12957096. doi:10.1016/S0140-6736(03)14234-1.
- Jansen AC, van Aalst-Cohen ES, Tanck MW, et al. . J. Intern. Med. 2004, 256 (6): 482–90. PMID 15554949. doi:10.1111/j.1365-2796.2004.01405.x.
- Repas TB, Tanner JR. . J Am Osteopath Assoc. February 2014, 114 (2): 99–108 [2015-09-19]. PMID 24481802. doi:10.7556/jaoa.2014.023. (原始内容存档于2014-03-11).
- Hobbs HH, Brown MS, Goldstein JL. . Hum. Mutat. 1992, 1 (6): 445–66. PMID 1301956. doi:10.1002/humu.1380010602.
- Vega GL, Grundy SM. . J. Clin. Invest. 1986, 78 (5): 1410–4. PMC 423848
 . PMID 3771801. doi:10.1172/JCI112729.
. PMID 3771801. doi:10.1172/JCI112729. - Brown MS, Goldstein JL. . Proc. Natl. Acad. Sci. U.S.A. 1974, 71 (3): 788–92. PMC 388099
 . PMID 4362634. doi:10.1073/pnas.71.3.788.
. PMID 4362634. doi:10.1073/pnas.71.3.788. - National Institute for Health and Clinical Excellence. Clinical guideline 71: Familial hypercholesterolaemia. London, 2008.
- Kastelein JJ, Akdim F, Stroes ES, et al. . N. Engl. J. Med. April 2008, 358 (14): 1431–43. PMID 18376000. doi:10.1056/NEJMoa0800742.
- Scientific Steering Committee on behalf of the Simon Broome Register Group. . Atherosclerosis. 1999, 142 (1): 105–12. PMID 9920511. doi:10.1016/S0021-9150(98)00200-7.
- Neil A, Cooper J, Betteridge J, et al. . Eur. Heart J. November 2008, 29 (21): 2625–33 [2015-09-18]. PMC 2577142
 . PMID 18840879. doi:10.1093/eurheartj/ehn422. (原始内容存档于2016-12-20).
. PMID 18840879. doi:10.1093/eurheartj/ehn422. (原始内容存档于2016-12-20).