托品酮
托品酮(Tropinone)是一个莨菪烷类生物碱,通常情况下为针状结晶(汽油),用作合成阿托品硫酸盐的中间体。它是有机合成史上值得一提的一个生物碱分子。[1][2]
| 托品酮 | |
|---|---|
 | |
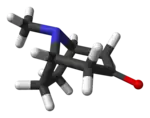 | |
| IUPAC名 8-Methyl-8-azabicyclo[3.2.1]octan-3-one 8-甲基-8-氮杂双环[3.2.1]辛烷-3-酮 | |
| 英文名 | |
| 别名 | 3-托品酮 |
| 识别 | |
| CAS号 | 532-24-1 |
| PubChem | 446337 |
| ChemSpider | 393722 |
| SMILES |
|
| InChIKey | QQXLDOJGLXJCSE-KNVOCYPGBG |
| DrugBank | DB01874 |
| 性质 | |
| 化学式 | C8H13NO |
| 139.195 g·mol⁻¹ | |
| 外观 | 棕色固体 |
| 熔点 | 42.5 °C(316 K) |
| 沸点 | 分解 |
| 危险性 | |
| NFPA 704 |
 1
2
0
|
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
用托品酮在碱存在下与碳酸二甲酯反应生成2-甲氧羰基托品酮,然后使产物在雷尼镍存在下加氢生成甲基芽子碱,最后将甲基芽子碱与苯甲酰氯在吡啶存在下发生酯化反应,就可以得到可卡因。
合成
全合成
托品酮最早的全合成是由里夏德·维尔施泰特在1901年完成的。
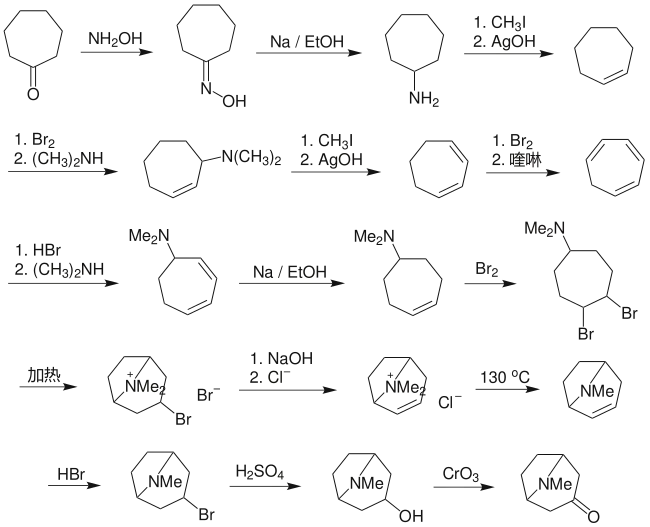
里夏德·维尔施泰特(1915年诺贝尔化学奖得主)以环庚酮作为起始原料,尽管路线中每一步的产率均较高,但由于步骤较多,使总产率大大降低,只有0.75%。[3]当然,在20世纪初能人工合成出结构这样复杂的化合物,已经是对有机合成化学发展的很大贡献。这是早期在实验室装配复杂天然产物的重要事件之一。对这一相当复杂的天然分子的装配成功,是有机合成在经典时期的顶峰,标志着多步全合成的诞生。
在合成托品酮之前,维尔施泰特在1898年已经成功以托品酮为原料,首次成功地合成了可卡因,并且阐明了可卡因的结构。[4]
1917年,罗伯特·鲁宾逊创造了简短的托品酮合成法。该法是有机合成中的经典路线之一,仅以结构简单的丁二醛、甲胺和3-氧代戊二酸为原料,在仿生条件下,利用曼尼希反应,仅通过三步反应(一锅反应)就合成了托品酮,而且产率达到17%,经改进后可以超过90%。[5]
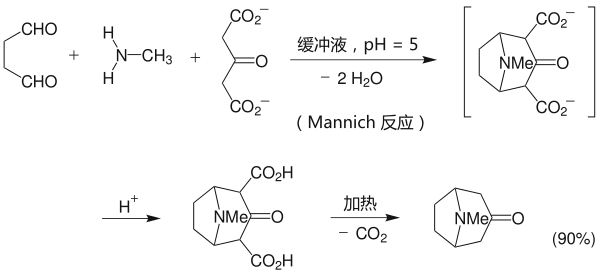
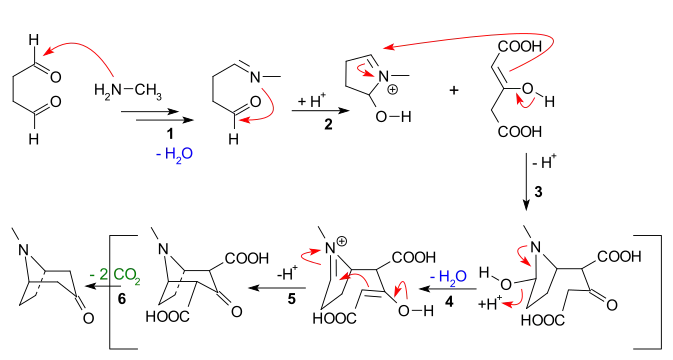
该反应的机理为:
- 一级胺对醛的亲核加成,而后失水生成亚胺;
- 亚胺分子内的亲核加成,构建出第一个环;
- 烯醇负离子与丙酮二羧酸根离子之间的分子间曼尼希反应;
- 失水生成一个新的烯醇负离子和一个新的亚胺;
- 分子内曼尼希反应,生成第二个环;
- 脱去两个羧基生成托品酮
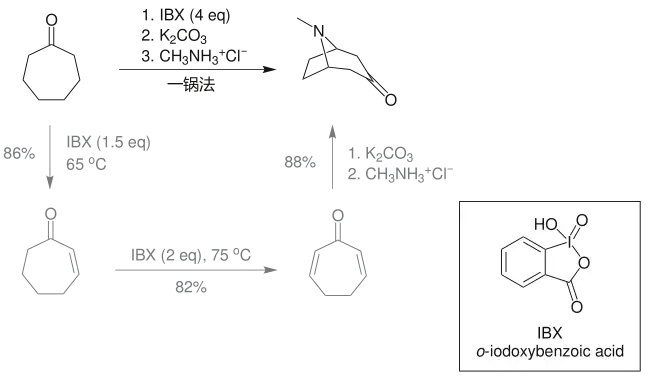
最近,K. C. Nicolaou 采用过量的2-碘酰基苯甲酸(IBX)试剂,利用一锅法反应,将醇(环庚醇)氧化成酮的同时形成α,β-不饱和结构,进一步加入甲胺可直接生成托品酮及其类似物:
生物合成
在生物体内,用于构建可卡因环系的托品酮衍生物是以L-谷氨酰胺或L-精氨酸为原料合成的。[6]首先,这两种氨基酸先通过羰基的还原或脱脲作用生成L-鸟氨酸,然后鸟氨酸脱羧生成腐胺。接着,腐胺中的一个氮原子被SAM甲基化,生成N-甲基腐胺。N-甲基腐胺在二胺氧化酶的催化下转化为4-甲氨基丁醛,并环化为席夫碱N-甲基-Δ1-吡咯啉盐正离子。
此后,N-甲基-Δ1-吡咯啉盐正离子与乙酰辅酶A进行克莱森缩合,得到两种在吡咯烷环2-位取代的对映异构产物,但两种产物中只有(S)-异构体能继续环化生成莨菪烷的骨架。硫酯产物继续与另一分子乙酰辅酶A继续缩合,得到丁二酸硫酯的4-衍生物。[7]后者发生氧化,重新产生吡咯啉盐正离子,并产生一个烯醇负离子,两者发生缩合(分子内曼尼希反应),产生托品酮的4-位被-C(O)SCoA基取代的产物。接着硫酯基被水解生成羧酸,羧酸再被SAM甲基化为甲酯,并在NADPH作用下双键被还原,得到甲基芽子碱。最后甲基芽子碱与从苯丙氨酸 -> 肉桂酸 -> 路线生成的苯甲酰基辅酶A缩合为可卡因。[8][9]
参见
- 6-羟基托品酮、6-乙酰氧基托品酮
- 托品酮还原酶Ⅱ
- 莨菪烷
参考资料
- R. Robinson. . Journal of the Chemical Society, Transaction. 1917, 111: 762–768. doi:10.1039/CT9171100762.
- The Art and Science of Total Synthesis at the Dawn of the Twenty-First Century K. C. Nicolaou, Dionisios Vourloumis, Nicolas Winssinger, and Phil S. Baran Angew. Chem. Int. Ed. 2000, 39, 44 ± 122
- Smit, W. et al. (1998) Organic Synthesis, The Science behind the Art. Cambridge: The Royal Society of Chemistry.
- Andrew J. Humphrey and David O'Hagan. Tropane alkaloid biosynthesis. A century old problem unresolved. Natural Products Reports 2001, 18, 494-502.doi:10.1039/b001713m
- Arthur J. Birch. Investigating a Scientific Legend: The Tropinone Synthesis of Sir Robert Robinson, F.R.S. Notes and Records of the Royal Society of London, 1993, 47, 277-296.
- Leete E, Marion L, Sspenser ID. . Nature. October 1954, 174 (4431): 650–1. PMID 13203600.
- Dewick, P. M. . Chicester: Wiley-Blackwell. 2009. ISBN 978-0-4707-4276-1.
- E. Leete, J. A. Bjorklund and S. H. Kim. . Phytochemistry. 1988, 27: 2553. doi:10.1016/0031-9422(88)87026-2.
- [. [2011-12-27]. (原始内容存档于2016-03-05). Tropinone字典-Guidechem.com(英文)]