拉替拉韦
拉替拉韦(Raltegravir,缩写:RAL,商品名艾生特)是一种口服抗逆转录病毒药物,临床应用其钾盐形式(拉替拉韦钾)用于治疗艾滋病 。[1]它还可以作为暴露后预防疗法用于预防艾滋病。[2]该药是一种整合酶抑制剂,可阻断病毒复制所需的HIV整合酶的功能。
 | |
 | |
| 臨床資料 | |
|---|---|
| 商品名 | 艾生特(Isentress) |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a608004 |
| 核准狀況 |
|
| 懷孕分級 |
|
| 给药途径 | 口服 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 藥物動力學數據 | |
| 生物利用度 | 60%(FDA) |
| 血漿蛋白結合率 | 83% |
| 药物代谢 | 肝脏代谢 (UGT1A1) |
| 生物半衰期 | 9小时 |
| 排泄途徑 | 肾脏排泄和肠道排泄 |
| 识别 | |
| |
| CAS号 | 518048-05-0 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| NIAID ChemDB | |
| PDB配體ID | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.124.631 |
| 化学 | |
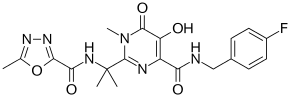
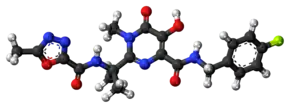
| 化学式 | C20H21FN6O5 |
| 摩尔质量 | 444.42 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
拉替拉韦于2007年在美国被批准用于医疗用途,[2]该药同时为世界卫生组织基本药物。[3]
临床应用

拉替拉韦钾片剂
拉替拉韦最初仅被批准用于对其他抗逆转录病毒药物具有耐药性的患者。[4]2009年7月,FDA批准该药作为一线药物治疗AIDS。[5]与其他HAART药物一样,由于HIV的高度致突变性,该药一般与其他作用机制的抗逆转录病毒药物(如拉米夫定)联合使用以降低HIV的耐药性。
2011年12月,该药被批准用于2-11岁的儿童,11岁以上的青少年则按照成人剂量用药。[6]
研究
研究表明,拉替拉韦显着改变了HIV的病毒动力学。在临床试验中,服用拉替拉韦钾的患者比服用非核苷类逆转录酶抑制剂或蛋白酶抑制剂的患者能更快地达到低于每毫升50个拷贝的病毒载量。这种病毒载量减少的统计学显着差异导致一些HIV研究人员开始质疑长期以来关于HIV病毒动力学和衰减的范式。[13][14]
对人巨细胞病毒终止酶蛋白的研究表明,拉替拉韦可能会阻止疱疹病毒的复制。[15]
2013年1月,默沙东启动了一项II期试验,以评估拉替拉韦在治疗多发性硬化症(MS)中的疗效。[16]该药物对人内源性逆转录病毒(HERV)和EB病毒具有活性,这已在复发缓解型MS的发病机制中得到证实。
参考文献
- 69. British Medical Association. 2015: 429. ISBN 9780857111562.
- . The American Society of Health-System Pharmacists. [8 December 2017]. (原始内容存档于2017-12-11).
- . Geneva: World Health Organization. 2019. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- . U.S. Food and Drug Administration (FDA). February 22, 2008 [2009-11-15]. (原始内容存档于2012-10-17).
- . Reuters. 2009-07-10 [2021-07-01]. (原始内容存档于2021-05-14).
- . [2021-07-01]. (原始内容存档于2013-12-19).
- . J. Acquir. Immune Defic. Syndr. 2007, 46 (2): 125–33. PMID 17721395. doi:10.1097/QAI.0b013e318157131c.
- Stephenson J. . JAMA. 2007, 297 (14): 1535–6. PMID 17426263. doi:10.1001/jama.297.14.1535.
- . Drugs. 2009, 69 (8): 1059–75 [2021-07-01]. PMID 19496631. doi:10.2165/00003495-200969080-00007. (原始内容存档于2011-10-08).
- . www.thebody.com. [2021-07-01]. (原始内容存档于2020-06-04).
- Durrant, Jacob D.; McCammon, J. Andrew. . BMC Biology. October 28, 2011, 9 (1): 71. PMC 3203851
 . PMID 22035460. doi:10.1186/1741-7007-9-71.
. PMID 22035460. doi:10.1186/1741-7007-9-71. - . Journal of Medicinal Chemistry. March 6, 2008, 51 (18): 5843–5855. PMID 18763751. doi:10.1021/jm800245z.
- . www.thebodypro.com. [2021-07-01]. (原始内容存档于2020-08-06).
- Clinical trial number NCT00554398 for "Impact of MK-0518 (Raltegravir) Intensification on HIV-1 Viral Latency in Patients With Previous Complete Viral Suppression" at ClinicalTrials.gov
- . ScienceDaily. [2021-07-01]. (原始内容存档于2016-03-05).
- . clinicaltrials.gov. [2021-07-01]. (原始内容存档于2020-08-06).
外部链接
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.