核素
核素(英語:),又稱,是指具有特定質子數(原子序数)、中子數和核能态的原子種類。[1]凡原子核構造不同的原子,例如質子數或中子數不同,皆視為不同的核素,例如氕、氘、碳-12、碳-14、鈾-235、鈾-238等皆為不同的核素。而有些原子的原子核雖然構造相同,但只要其所處的能態不同(基態或半衰期超過10−9秒的亞穩態),亦視為不同核素,例如鎝-99和鎝-99m。[2]
名称由来
核素一词在英文中被叫做“nuclide”,这一单词来源于拉丁语 nucleus(核)和古希腊语 εἶδος [3][4](可见形态),是由这两个词复合而成的。
1947年美国科学家杜魯門·保羅·寇曼提出“核素”一词,寇曼将它定义为:“具有给定质子数Z和中子数N的一类原子核所组成的元素”。[5][6]目前许多国家仍然在采用这一定义,但当涉及到活度的定义时,这种定义就显得不够完善了。
表示方法
核素的名稱通常以其所屬元素加上其質量數來表示,例如氦-3、氦-4、碳-12、碳-14、鈾-235、鈾-238等。[7]當使用化學符號表示核素時,通常使用的形式,其中E為該核素所屬元素的化學符號(氘和氚这二種核素有自己的符号:D和T);Z為該核素的質子數(即原子序數);A為該核素的質量數(即核子數,質子數和中子數之和);N為該核素的中子數(一般情况下不標出),例如3
2He
、4
2He
、12
6C
、14
6C
、235
92U
、238
92U
。由於從核素的所屬元素便可推知其質子數,因此以符號表示核素時通常只會註明其上標的質量數,而省略下標的質子數,如3
He
、4
He
、12
C
、14
C
、235
U
、238
U
。若在核素符號的質量數後加上字母m,則表示其為核同质异能素,其原子核處於較高能階的亞穩態,但半衰期比一般的激發態原子核要長(通常達到100~1000倍的時間),例如99m
Tc
(鎝-99m)、242m
Am
(鋂-242m)等。當一基態核素的原子存在多個不同能階的核同质异能素時,則使用m1、m2、m3等,按照其激發能量從低到高進行標記,如177m2
Hf
(鉿-177m2)等。
与同位素概念的区别
核素的定義主要聚焦在原子核的层面,不仅考虑原子核內中子数与质子数的差异,同时也考虑了影响核性质的另一主要因素,即核能态的不同,对原子核的性质描述更深入,涉及核力、核结构及原子核的大小、自旋、宇称、电四极矩等。而同位素的概念則更加強調原子化學性質的異同,將質子數相同的原子歸類為同一種元素的同位素。中子數對原子的核性質有很大的影響,但對大多數原子的化學性質之影響可忽略不計。儘管對於較輕的元素,其核內中子數與質子數之比在同位素之間變化較大,對其化學性質的影響通常也十分微小。
核素一詞可用於稱呼任何原子核構造或所處能態不同的原子種類,如質子數或中子數不同的原子,皆視為不同的核素。而同位素一詞最初主要用於稱呼質子數相同而中子數不同的原子,稱其為同一種元素的不同同位素。然而,由於同位素一詞在學界中使用歷史較為悠久,比核素一詞更廣為人知,如今在核技術和核醫學等許多領域中仍常用「同位素」指代任何具有特定質子數及中子數的原子種類,儘管在概念及語意上使用「核素」更為合適。
種類
儘管核素和同位素這兩個術語在一般語境中經常相互替代使用,但狹義上同位素專指質子數相同而中子數不同的核素。下表列出了其他描述核子數或核能態間具有特性關係的核素術語:
| 術語 | 特性關係 | 示例 | 備註 |
|---|---|---|---|
| 同位素 | 質子數(原子序數)相同的核素(Z1 = Z2) | 12 6C 、13 6C 、14 6C |
互為同位素的核素由於原子序相同,故屬於同一種元素 |
| 同中子素 | 中子數相同的核素(N1 = N2) | 13 6C 、14 7N 、15 8O |
|
| 同量素 | 質量數相同的核素(Z1 + N1 = Z2 + N2) | 17 7N 、17 8O 、17 9F |
放射性核素及其發生β衰變後的子核素互為同量素 |
| 同差素 | 中子數與質子數之差相同的核素(N1 − Z1 = N2 − Z2) | 13 6C 、15 7N 、17 8O |
放射性核素及其發生α衰變後的子核素互為同差素[8] |
| 鏡像核 | 中子數與質子數彼此互換的一對核素 (Z1 = N2 且 Z2 = N1) |
3 1H 、3 2He |
鏡像核彼此互為同量素 |
| 核同质异能素 | 質子數和中子數皆相同,但核能態不同的核素 | 99 43Tc 、99m 43Tc |
m意為亞穩態(metastable),指壽命較長的激發態(半衰期>10−9秒) |
核同质异能素是指質子數及中子數相同,但原子核處於不同能階的核素。通常處於激發態的原子核會在無法直接測量的極短時間(約10−12秒)內發生γ衰變,轉變成能階較低的原子核。不過有些激發態原子核的半衰期比常見的激發態原子核的半衰期要長(>10−9秒),因此被稱作處於亞穩態,這種處於亞穩態的高能階原子核在核物理學上被視為和基態原子核不同的核素,稱為核同质异能素,例如亞穩態的99m
43Tc
是基態的99
43Tc
的核同质异能素。由於核同质异能素的核子組成和基態核素完全相同,因此在定義上它們被算作同一種同位素,不過由於核能態的差異,他們仍被視為不同的核素。目前已知壽命最長的亞穩態核同质异能素是180m
73Ta
,其半衰期超過1000兆年,是原始核素之一,並且從未被觀察到其衰變成基態。相比之下,其基態核素180
73Ta
的半衰期僅約8小時。
核穩定性
原子核中不同數目的質子和中子的組合會影響其穩定性,因此每種核素的核穩定性各不相同。
目前已知的大多數核素原子核皆不穩定,具有放射性,會自發性地放出游離輻射並衰變成其他核素,稱為放射性核素,例如3
1H
、14
6C
、40
19K
、60
27Co
、131
53I
、137
55Cs
和235
92U
等。每種放射性核素的核穩定性各不相同,因此發生衰變的半衰期也有長有短,原子核越不穩定的核素半衰期越短,放射性越強。目前已發現的放射性核素超過3000種[9],其中大部分不存在於自然界,只能藉由人工合成的方式生成,稱為人造放射性核素。至於天然存在的放射性核素則包括半衰期極長的原始放射性核素、原始放射性核素衰變生成的次生天然放射性核素以及宇宙射線作用產生的宇生放射性核素等。
原子核穩定、不會發生放射性衰變的核素則稱為穩定核素,共有251種,皆自然存在於地球上,分別屬於原子序1號(氫)至82號(鉛)的化學元素(鎝和鉕除外)。穩定核素由於不會衰變成其他核素,自恆星核合成過程誕生後能以穩定的量恆久存在,因此構成了現今自然界中絕大多數的物質,大多數元素在地球和太陽系中同位素的豐度比例往往也是穩定同位素占絕大部分或全部。不過自然界中有三種元素(碲、銦和錸)雖然有著穩定同位素,但其豐度最高的同位素卻是壽命極長的放射性同位素。
理論計算顯示,許多表面上為“穩定”的核素在能量上容易受到一些已知衰變形式的影響,例如α衰變或雙β衰變(不考慮尚未證實的質子衰變,因為這將使所有核素皆屬不穩定),然而目前尚未觀察到任何它們發生衰變的現象,因此這些核素被認為是“觀測上穩定”的核素。這些核素的預測半衰期往往遠超宇宙的估計年齡。此外,理論上所有比93
41Nb
重(含)的核素都有可能自發分裂,然而目前觀測到會進行此衰變的最輕核素為232
90Th
。
影響核穩定性的因素
核子數的比例
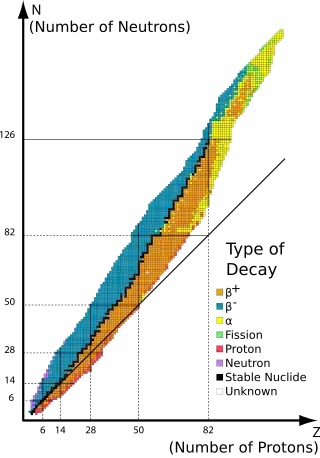
黑色 – 穩定核素
其他顏色 – 放射性核素,各顏色表示該核種的主要衰變形式
圖中的對角線表示質子數與中子數相同(中子-質子比為1)的核素。由此圖可歸納出:質子數超過20的穩定核素所含的中子數皆大於質子數,且核子數越多,中子-質子比越大。
原子核中的核子通過殘留強力結合在一起(只有一個核子的氕 1
1H
除外)。由於質子帶正電,故彼此相互排斥。而中子是電中性的,它能以兩種方式穩定原子核:中子的存在能將核中的質子稍微間隔開,減少了質子間的靜電斥力,且中子會對周遭核子施加吸引的核力。因此,兩個以上的質子需要伴隨一至多個中子才能結合成原子核。隨著質子數量的增加,確保原子核穩定所需的中子-質子比(N/Z)也隨之增大(見圖)。例如3
2He
的中子-質子比為1/2,而高原子序的238
92U
之中子-質子比則超過3/2。許多較輕的元素具有中子-質子比為1(即Z = N)的穩定同位素,其中40
20Ca
是已知中子-質子比為1的穩定核素中質量最重的。所有比40
20Ca
重的穩定核素所含的中子數皆大於質子數(即中子-質子比>1),參看配圖。
核子數的奇偶性
| A | 偶數 | 奇數 | 總計 | ||
|---|---|---|---|---|---|
| Z與N | 偶偶核素 | 奇奇核素 | 偶奇核素 | 奇偶核素 | |
| 穩定核素 | 145 | 5 | 53 | 48 | 251 |
| 150 | 101 | ||||
| 長壽放射性核素 | 22 | 4 | 4 | 5 | 35 |
| 26 | 9 | ||||
| 原始核素 | 167 | 9 | 57 | 53 | 286 |
| 176 | 110 | ||||
中子-質子比並不是影響核穩定性的唯一因素。原子核的穩定性還會受到質子數(Z)、中子數(N)及質量數(A)是偶數還是奇數所影響。原子核中的質子或中子互相成對能相互抵消角動量,是形成穩定核的條件之一。Z、N或A為奇數往往會降低核結合能,從而使奇數核通常不太穩定。故大多數穩定核素皆為Z與N都是偶數(故A也是偶數)的偶偶核。也有部分穩定核素屬於A為奇數的奇偶核(Z為奇數,N為偶數)或偶奇核(Z為偶數,N為奇數)。至於奇奇核(Z和N都是奇數)絕大多數都不穩定,屬於奇奇核的穩定核素非常稀少。[2]
幻數原子核
質子數或中子數為幻數的原子核會顯現出較高的穩定性。目前已經確認的幻數皆為偶數,包括2、8、20、28、50、82和126這七個數目,而氦、氧、鈣、鎳、錫、鉛等六個元素的質子數分別與2到82的幻數相對應,這些元素都具有多個穩定同位素,其中錫的穩定同位素多達10種,居所有元素之冠。至於質子數為126的元素Ubh目前尚未發現,預計其處於放射性超重元素穩定島的中央。當原子核之質子數和中子數皆為幻數時,該情況稱為「雙幻數」,許多具有雙幻數的核素都顯得異常穩定,例如4
2He
、16
8O
、40
20Ca
和208
82Pb
都是密閉核組態的穩定核素,48
20Ca
則是壽命極長的原始放射性核素。[2][10]
存在及來源
地球上大約有339種自然存在的核素[11],分屬於94種化學元素(1號的氫至94號的鈽),其中有251種為穩定核素,其餘則是不穩定的放射性核素。
在這339種天然核素中,有286種是自太陽系形成之前恆星核合成過程中誕生的原始核素。原始核素包括251種穩定核素,以及35種半衰期極長(至少長於地球年齡的2%)的放射性核素。[11]由於這些放射性核素的半衰期非常長,衰變速率緩慢,因此它們的原子從形成之初經歷數十億年後仍得以相當的量存留到現在,其中最重的三種原始放射性核素在地殼中的衰變過程組成了現今自然界中三條最主要的衰變鏈,分別是以鈾-238(t1⁄2=4.49×109年)為母體的鈾系、以鈾-235(t1⁄2=7.13×108年)為母體的錒系和以釷-232(t1⁄2=1.39×1010年)為母體的釷系。[10]除了前述三者外,還有約32種原始放射性核素並不屬於上述三大衰變鏈之内,例如鉀-40(t1⁄2=1.2×109年)、銣-87(t1⁄2=6.0×1010年)、銦-115(t1⁄2=6×1014年)、鑭-138(t1⁄2=1.2×1011年)、釤-147(t1⁄2=2.5×1011年)、鎦-176(t1⁄2=2.4×1010年)、錸-187(t1⁄2=4×1012年)和鉍-209(t1⁄2=2.01×1019年)等。
除了286種原始核素外,自然界中還存在著50餘種半衰期較短的放射性核素。這些壽命較短的天然放射性核素中,鐳-226、氡-222和釙-210等質量數超過200的核素大多為釷和鈾的衰變產物,是三大衰變鏈的中間產物。礦場和地下室的放射性危害通常是由這些短壽命核素造成的,尤其是容易擴散和被吸入的氡氣,為的主要來源,是僅次於吸菸的第二個造成肺癌的主要原因。[12]
天然核反應也會產生許多短壽命的放射性核素,例如宇宙射線作用產生的宇生放射性核素(氚、碳-14等)[10],以及地球上的原子發生自發裂變、中子捕獲等作用產生的核生成核素(鎝-99、鈽-239等)。
還有約3000種放射性核素不存在於現今的自然界中,只能藉由核反應爐和粒子加速器人工合成[10],這些人造核素大多半衰期極短,即使在地球形成的初期曾經存在,也早已全部衰變殆盡。不過許多在地球上不天然存在的短壽命核素卻可在宇宙的光譜中觀測到,它們是在恆星或超新星中自然產生的,例如鋁-26在自然界中極為罕見,僅有宇宙射線散裂產生的痕量存在,但其在宇宙中的含量卻達到天文規模。
依穩定性分級的核素統計表
請注意,下表中的數據並不一定准確,在未來可能會發生變化(比如某些觀測上穩定的核素可能具有放射性,但半衰期極長而難以觀測其衰變)。
| 核穩定性等級 | 核素數量 | 累積總計 | 註釋 |
|---|---|---|---|
| 穩定(不考慮質子衰變) | 90 | 90 | 包含週期表中前40種元素的所有穩定同位素。 目前尚未觀測到質子衰變的現象。 |
| 理論上對一或多種已知的衰變模式不穩定,但尚未觀測到其發生衰變(即觀測上穩定) | 161 | 251 | 通常認定的穩定核素總數即為251種。 理論上比93 41Nb 重(含)的穩定核素都有可能自發分裂。 |
| 放射性原始核素 | 35 | 286 | 半衰期至少超過108 年(1億年)的長壽放射性核素。 |
| 半衰期超過1小時的放射性核素 | 619 | 905 | |
| 半衰期短於1小時的放射性核素 | >2400 | >3300 | |
參考文獻
- IUPAC. . A. D. McNaught; A. Wilkinson (编). . Blackwell Scientific Publications. 1997 [2023-08-08]. ISBN 978-0-632-01765-2. doi:10.1351/goldbook.N04257. (原始内容存档于2016-12-01).
- 葉錫溶 蔡長書. . 台灣台北縣: 新文京開發出版股份有限公司. 2008-03-26. ISBN 978-986-150-830-6 (中文(臺灣)).
- . [2021-11-20]. (原始内容存档于2021-11-20).
- . [2021-11-20]. (原始内容存档于2021-11-20).
- Kohman, Truman P. . American Journal of Physics. 1947, 15 (4): 356–7. Bibcode:1947AmJPh..15..356K. doi:10.1119/1.1990965.
- Belko, Mark. . Pittsburgh Post-Gazette. 1 May 2010 [29 April 2018]. (原始内容存档于2019-12-14).
- IUPAC (Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; and Hutton, A. T.), Nomenclature of Inorganic Chemistry – IUPAC Recommendations 2005 (页面存档备份,存于), The Royal Society of Chemistry, 2005; IUPAC (McCleverty, J. A.; and Connelly, N. G.), Nomenclature of Inorganic Chemistry II. Recommendations 2000, The Royal Society of Chemistry, 2001; IUPAC (Leigh, G. J.), Nomenclature of Inorganic Chemistry (recommendations 1990), Blackwell Science, 1990; IUPAC, Nomenclature of Inorganic Chemistry, Second Edition 的存檔,存档日期2016-03-03., 1970; probably in the 1958 first edition as well
- Sharma, B.K. 7th. Krishna Prakashan Media. 2001: 78. ISBN 978-81-85842-63-9.
- . [2 January 2016]. (原始内容存档于2016-12-23).
- 魏明通. . 五南圖書出版股份有限公司. 2005. ISBN 978-957-11-3632-5.
- .
- . [2010-04-05]. (原始内容存档于2015-02-08).