鈾
已知的鈾同位素都不稳定,其中以最長壽的鈾-238(半衰期44.7億年)和鈾-235(半衰期7.04億年)在自然界中最為普遍。鈾是在地球上大量存在的原始元素中原子序最高的[3],原子序大於鈾的超鈾元素由於半衰期較短,從地球誕生至今早已衰變殆盡,且現今自然界中也缺乏形成它們的途徑或機制,因此都是以人工合成的方法发现的,僅有錼和鈽等原子序較小的超鈾元素被發現在鈾礦中痕量生成。自然界中的鈾以三种同位素的形式存在:鈾-238(占天然鈾的99.2739至99.2752%)、鈾-235(占0.7198至0.7202%)、和微量的鈾-234(占0.0050至0.0059%)。[4]天然鈾在衰變時會釋放出α粒子。[5]由於天然鈾同位素的半衰期極長,因此它们被用于估算地球的年齡。
鈾獨特的核子特性有很大的實用價值。鈾-235是唯一易分裂的天然鈾同位素,可被慢中子撞击而裂变,如果其质量超过临界质量,就都能夠維持核連鎖反應,在核反应过程中的微小质量损失会转化成巨大的能量。这一特性使它廣泛被用於核能發電以及生产核武器。然而,其在大自然存在的濃度很低,必須經過濃縮方可使用。耗尽鈾-235后的发电原料被称为貧鈾(組成以鈾-238為主),可用做钢材添加剂,製造贫铀弹和裝甲。鈾-233也是一種易分裂同位素,唯自然存量極少,一般由天然的釷-232製備。鈾-238自發裂變的機率极低,但快中子撞擊可诱导其裂變,屬於增殖性材料,即能在核反應爐中經核嬗變成為易分裂的鈈-239。[6]
1789年,馬丁·克拉普羅特在瀝青鈾礦中發現鈾元素,並將其以天王星(Uranus)命名。尤金-梅爾希奧·皮里哥首次分離出鈾金屬。當時鈾被用作玻璃和陶瓷的著色劑,能产生檸檬黃色至綠色,稱為鈾玻璃,而鈾玻璃在紫外線照射下會散發綠色瑩光。早期攝影曾使用鈾為照片著色和暈渲。1896年,亨利·貝可勒爾發現鈾的放射性。1934年起恩里科·費米、奧托·哈恩、莉澤·邁特納及羅伯特·歐本海默等人進行研究,使鈾成為核能工業所用的燃料和用於轟炸廣島的小男孩原子彈原料。冷戰期間美國和蘇聯進行軍備競賽,生產數萬個含鈾或衰變產物為鈾-235的鈈-239的核武器。苏联解体后苏联核武器的安全问题受到公众的关注[7]。
特性

提純後的鈾金屬呈銀白色,屬硬度較高的元素之一。鈾金屬具延展性和可鍛性,呈輕微順磁性,電正性高,電導性低。[8][9]鈾金屬的密度非常高,它比鉛金屬高70%,但比金及鎢稍低。
幾乎所有非金屬元素及其化合物都可與鈾發生反應,反應活性隨溫度而提高。[10] 铀可快速溶于室温下的盐酸,而硝酸在加热条件下也可将铀溶解,而除氫氯酸外的非氧化性酸對鈾的侵蝕則很慢。[8]鈾金屬粉末可與冷水反應。空氣中,鈾的表面會形成一層深色氧化鈾。[9]礦石中的鈾可通過化學方法提取出來,並轉化為二氧化鈾或其他工業可用的化學形態。
鈾-235是首個被發現的易裂變同位素。其他自然產生的同位素為「可裂變」物質,而非「易裂變」(兩者之別請見易分裂材料)。在慢中子的撞擊下,鈾-235主要會分裂成兩個較小的原子核,同時釋放核結合能及更多的中子。當這些新產生的中子被足夠多的原子核吸收,就會產生核連鎖反應,瞬時發熱或(在特殊情況下)發生爆炸。核反應爐會使用中子毒物,通過吸收多餘的自由中子,來控制這類核連鎖反應的速度。這種吸收中子的物質通常置於反應爐的控制棒中。
只要大約7公斤的鈾-235就能夠製成原子彈。[11]首次用於戰爭中的核彈小男孩原子彈使用的便是鈾元素的核裂變反應,而首個核彈及摧毀長崎的胖子原子彈用的則是鈈元素。
鈾-238的衰變鏈
U(鈾)-238 —(α衰變)—> Th(釷)-234 —(β衰變)—> Pa(鏷)-234 —(β衰變)—> U(鈾)-234 —(α衰變)—>
Th(釷)-230 —(α衰變)—> Ra(鐳)-226 —(α衰變)—> Rn(氡) -222 —(α衰變)—> Po(釙)-218 —> a. 或 b.
a. —(α衰變)—> Pb(鉛)-214 —(β衰變)—> Bi(鉍)-214 —> c. 或 d.
b. —(β衰變)—> At(砹)-218 —(α衰變)—> Bi(鉍)-214 —> c. 或 d.
c. —(α衰變)—> Tl(鉈)-210 —(β衰變)—> Pb(鉛)-210 —> e. 或 f. 或 g.
d. —(β衰變)—> Po(釙)-214 —(α衰變)—> Pb(鉛 -210) —> e. 或 f. 或 g.
e. —(α衰變)—> Hg(汞)-206 —(β衰變)—> Tl(鉈)-206 —(β衰變)—> Pb(鉛)-206 [穩定]
f. —(β衰變)—> Bi(鉍)-210 —(α衰變)—> Tl(鉈)-206 —(β衰變)—> Pb(鉛)-206 [穩定]
g. —(β衰變)—> Bi(鉍)-210 —(β衰變)—> Po(釙)-210 —(α衰變)—> Pb(鉛)-206 [穩定]
化合物
氧化物
氧鈾系統中物質的相態非常複雜。鈾的最常見氧化態為鈾(IV)和鈾(VI),分別對應於二氧化鈾(UO
2)和三氧化鈾(UO
3)。[13]其他存在的氧化物還有一氧化鈾(UO)、五氧化二鈾(U
2O
5)、過氧化鈾(UO
4·2H
2O)等等。
八氧化三鈾(U
3O
8)和二氧化鈾(UO
2)是鈾最常見的氧化物。這兩種氧化物都是固體,不易溶於水,在許多化學環境下都相對穩定。八氧化三鈾是最穩定的鈾氧化物,也是自然界中最常見的一種。二氧化鈾則是核反應爐中最常用的鈾燃料。在環境溫度下,UO
2會逐漸轉變為U
3O
8。因為鈾的氧化物都較穩定,所以鈾是以氧化物的形態儲存和棄置的。[14]
水溶化學

鈾具有不同氧化態的鹽,當中不少都溶於水,可在水溶液中進行研究。鈾的最常見離子態為U3+
(棕紅色)、U4+
(綠色)、UO+
2(不穩定)及UO2+
2(黃色),分別對應於U(III)、U(IV)、U(V)和U(VI)。[15]鈾(II)氧化態有UO和US等固態及半金屬化合物,但沒有可溶的簡單離子。U3+
離子不穩定,會從水中釋放出氫氣。鈾(VI)態對應鈾醯(UO2+
2)離子,有碳酸鈾酰、氯化鈾酰和硫酸鈾酰等化合物。UO2+
2能和各種有機螯合劑形成配合物,其中醋酸鈾酰最為常見。[15]
碳酸鹽
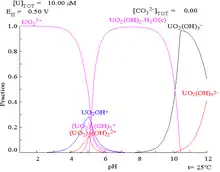
當鈾(VI)溶於碳酸鹽溶液而非純水中時,其普爾貝圖會因與碳酸離子的交互作用而有很大的變化。雖然大部分碳酸鹽都不溶於水,但碳酸鈾卻是可溶的。這是由於鈾(VI)陽離子可以與兩個氧化物及至少三個碳酸鹽形成陰離子配合物。
 |
 |
 |
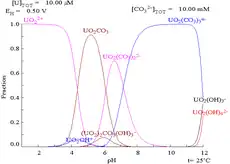 |
| 非配合物水溶液中的鈾(如高氯酸和氫氧化鈉)[18] | 碳酸鹽溶液中的鈾 | 非配合物水溶液中鈾的各個化學形態相對濃度[18] | 碳酸鹽溶液中鈾的各個化學形態相對濃度[18] |
酸鹼度的影響
從鈾的化學形態比例圖可以推論,鈾(VI)溶液的pH值提升,會使鈾形成水合氫氧化鈾,並在高pH值時形成氫氧化配合物陰離子。
當加入碳酸鹽後,pH值的提高會使鈾轉化為一系列的碳酸鹽配合物形態。特別在pH在6至8的時候,鈾的可溶性會提高,這有助長期穩定儲藏乏核燃料中的氧化鈾。
氫化物、碳化物及氮化物
鈾金屬在加熱至250到300攝氏度時,會與氫反應,形成氫化鈾。繼續加熱則會再次去除氫。因此氫化鈾可用於製造鈾的各種碳化物、氮化物和鹵化物。[19]氢化鈾具有兩種晶體相態:α型存在於低溫環境下,β型則在250 °C以上出現。[19]
碳化鈾與氮化鈾都是相對惰性的半金屬物質,能少許溶於酸中,並會與水反應及在空氣中燃點形成U
3O
8。[19]鈾的碳化物包括一碳化鈾(UC)、二碳化鈾(UC
2)和三碳化二鈾(U
2C
3)。向熔化鈾加入碳,或在高溫下把鈾金屬置於一氧化碳中,可產生UC和UC
2。U
2C
3在1800 °C以下穩定,通過對UC和UC
2的混合物進行機械施壓可以形成。[20]鈾金屬在直接接觸氮後所形成的氮化鈾包括:一氮化鈾(UN)、二氮化鈾(UN
2)及三氮化二鈾(U
2N
3)。[20]
鹵化物


所有的氟化鈾都是從四氟化鈾(UF
4)轉化而成的,UF
4則由二氧化鈾經氫氟化反應形成。[19]UF
4與氫在1000 °C反應後,會還原成三氟化鈾(UF
3)。在適當的溫度和壓力下,固態UF
4與氣態六氟化鈾(UF
6)反應後,可產生氧化態介乎兩者之間的氟化物:U
2F
9、U
4F
17和UF
5。[19]
在室溫底下,UF
6具有高蒸氣壓,這有助於用氣體擴散法把鈾-235從比例更高的鈾-238同位素中分離出來。通過以下反應,二氧化鈾和氢化鈾就能形成六氟化鈾。[19]
- UO
2 + 4 HF → UF
4 + 2 H
2O(500 °C,吸熱) - UF
4 + F
2 → UF
6(350 °C,吸熱)
所形成的UF
6是一種白色固體,化學活性極高(進行氟化反應),容易昇華(其氣態接近理想氣體)。它是已知的鈾化合物中揮發性最強的。[19]
要製造四氯化鈾(UCl
4),可以直接將氯與鈾金屬或氢化鈾結合。如果用氫還原UCl
4,可產生三氯化鈾(UCl
3);進一步進行氯化反應,則可產生氧化態更高的氯化鈾。[19]所有氯化鈾都能與水和空氣反應。
鈾的溴化物和碘化物可通過將鈾直接與溴或碘反應形成,或在氫溴酸或氫碘酸中加入UH
3。[19]這些化合物有UBr
3、UBr
4、UI
3和UI
4等等。鈾的氧鹵化物均可溶於水,例如UO
2F
2、UOCl
2、UO
2Cl
2和UO
2Br
2。鹵素的原子量越高,對應的氧鹵化物穩定性就越低。[19]
歷史
史前天然裂變
1972年,法國物理學家弗朗西斯·佩蘭分別在西非加蓬奧克洛的3個礦床中,發現了15處古天然核反應堆,今天已不再活躍。該礦床的年齡為17億年,當時地球上的鈾中,鈾-235占3%。[21]在適當環境下,這足以激發並維持核連鎖反應。
史前應用
人類最早使用鈾的天然氧化物,可以追溯到公元79年以前。當時氧化鈾被用來為陶瓷上黃色的彩釉。[9]1912年,英國牛津大學的R. T. Gunther在義大利那不勒斯灣波希里坡海角的古羅馬別墅中,發現了含1%氧化鈾的黃色玻璃。[22]從歐洲中世紀晚期開始,波希米亞約阿希姆斯塔爾(今捷克亞希莫夫)的居民就使用哈布斯堡銀礦中提取的瀝青鈾礦來製造玻璃。[23]19世紀初,人們所知的鈾礦僅在以上的地點。
發現
鈾元素是由德國化學家馬丁·克拉普羅特發現的。1789年,他在位於柏林的實驗室中,把瀝青鈾礦溶解在硝酸中,再用氫氧化鈉中和,成功沉澱出一種黃色化合物(可能是重鈾酸鈉)。[23]克拉普羅特假設這是一種未知元素的氧化物,並用炭進行加熱,得出黑色的粉末。他錯誤地認為這就是新發現的元素,但其實該粉末才是鈾的氧化物。[23][24]他以威廉·赫歇爾在八年前發現的天王星(Uranus)來命名這種新元素,而天王星本身是以希臘神話中的天神烏拉諾斯命名的。同樣地,百年後科學家發現首個超鈾元素錼(Neptunium)時也遵循鈾的命名方式以海王星(Neptune)命名之,其後的鈈(Plutonium)則以冥王星(Pluto)命名。[25]
1841年,巴黎中央工藝學校(Conservatoire National des Arts et Métiers)分析化學教授尤金-梅爾希奧·皮里哥把四氯化鈾和鉀一同加熱,首次分離出鈾金屬。[23][26]19世紀時人們沒有意識到鈾的放射性及危險性,因此發展了各種鈾的日常應用,其中包括歷史流傳下來的陶瓷和玻璃上色。
放射性的發現

1896年,亨利·貝可勒爾在位於巴黎的實驗室中,使用鈾元素發現了放射性。[10]貝可勒爾將硫酸鈾醯鉀(K2UO2(SO4)2)放在底片上,並置於抽屜當中。取出之後,他發覺底片出現了霧狀影像,且使用其他鈾鹽甚至鈾金屬,也會有一樣的效果。[27]他得出結論,鈾會發出一種不可見光或射線,在底片上留下了影像。
核裂變研究

以恩里科·費米為首的一個團隊在1934年觀察到,對鈾進行中子撞擊會產生β射線(即釋放出電子或正子)。[31]這些裂變產物起初被誤以為是原子序為93和94的新元素,它們分別被命名為Ausonium和Hesperium。[32][33][34][35]奧托·哈恩和弗里茨·施特拉斯曼在哈恩位於柏林的實驗室中進行了此項實驗,發現了鈾能夠分裂成為更小的原子核,並釋放出核結合能。[31]莉澤·邁特納和她的侄子奥托·罗伯特·弗里施於1939年2月刊登了該現象的物理解釋,並將這種過程稱為「核裂變」。[36]不久之後,費米猜測鈾的裂變所釋放的中子可能足以使這一裂變持續進行。1939年,這一假說得到了證實。科學家也發現,占少數的鈾-235同位素每次裂變平均可產生2.5個中子;[31]而占多數的鈾-238則可經核嬗變變為鈈,而鈈就像鈾-235一樣,能夠進行釋放熱中子的核裂變。這一發現促使多國開始進行製造核武器及運用核能的相關研究。
1942年9月2日,美國曼哈頓計劃中同樣以費米為首的另一團隊成功產生了首次人造核連鎖反應,稱Chicago Pile-1。團隊在芝加哥大學一個美式足球場地底進行此項實驗,其中使用了360噸石墨、53噸氧化鈾和5.5噸鈾金屬。[31][37]
原子彈
第二次世界大戰,美國主要研發了兩種原子彈:一種主要含鈾的炸彈,其中的可裂變物質為高濃縮鈾(代號「小男孩」);另一種為主要含鈈的炸彈,其鈈元素源自鈾-238(見三位一體核試及胖子原子彈)。「小男孩」是首個被用於戰爭當中的核武器,它在1945年8月6日於日本廣島上空爆炸。其爆炸當量為12,500噸TNT炸藥,引爆後的熱衝擊波摧毀了5萬幢房屋,導致7.5萬人死亡。(見廣島與長崎原子彈爆炸)。[27]起初人們以為鈾是一種稀有元素,透過壟斷所有現有鈾存庫便可避免核擴散。然而不過10年,大型鈾礦就在世界各地相繼被發現。[38]
反應爐

位於美國田納西州橡樹嶺國家實驗室的X-10石墨反應爐是世界上第二個人造核反應爐 ,也是第一個為持續作業而造的核反應爐。愛達荷州阿科鎮阿貢國家實驗室的EBR-I(實驗增殖反應爐一號)在1951年12月20日成為了首個產生電力的核反應爐。[39]最初該反應爐只點亮了4個150瓦燈泡,但經過改進,它最終可為整個實驗室供電。(其後,阿科鎮成為了世界上首個完全依赖核電的小鎮,其電力來自阿貢國家實驗室的另一個核能發電機BORAX-III。)[40][41]全球首個商業規模核電廠是位於前蘇聯的奧布寧斯克核電站,它於1954年6月27日投入使用。1954年,鸚鵡螺號成為了第一個使用核動力的潛水艇。[31][42]
核污染及冷戰後患
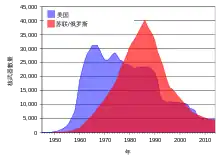
蘇聯及美國在1950年代至1960年代初,以及法國在1970至1980年代所進行的地面核試驗[43]使大量含有鈾的子同位素的輻射落塵散佈在世界各地。[44]多次核事故也加劇了放射性污染。[45][46]
鈾礦工人患癌症的機會比其他人較高。例如,有證據顯示納瓦霍鈾礦工人有較高機會患肺癌。[47]美國1990年通過的輻射曝露補償法規定,對所有確診患有癌症或其他呼吸道疾病的鈾礦工人給予10萬美元慰問金。[48]
美蘇冷戰期間,兩國收集並囤積了大量的鈾,並用此製造了上萬個核武器。在1991年蘇聯解體之後,540噸武器級高濃縮鈾(足以製成4萬個核彈頭)被存放在監管不嚴的地點,散佈在俄羅斯聯邦及其他前蘇聯國家。[11]亞洲、歐洲及南美洲各國警方在1993年和2005年之間,至少有16次截獲到走私的武器級鈾和鈈,大部分都來自前蘇聯。[11]美國聯邦政府在1993年至2005進行了材料保護、控制和衡算項目,動用了5.5億美元來保護位於俄羅斯的鈾鈈存庫。[11]《科學美國人》在2006年2月刊登文章,指出其中一處設施在改善項目進行之前,濃縮鈾是存放在掃帚櫃的,用來記錄核彈頭的卡片則放在鞋盒中。[49]
同位素
自然豐度
天然鈾元素主要由三種同位素組成:鈾-238(豐度為99.28%)、鈾-235(0.71%)和鈾-234(0.0054%)。它們均具有放射性,會釋放α粒子,但也有較小機會進行自發裂變。
鈾-238是最穩定的鈾同位素,半衰期約為4.468×109年,與地球的年齡相約。鈾-235的半衰期約為7.13×108年,而鈾-234的半衰期則約為2.48×105年。[50]天然鈾所釋放出的α粒子中,49%來自238U,同樣有49%來自234U,最後約2.0%來自235U。地球剛剛形成的時候,約有五分之一的鈾是鈾-235,而234U的豐度則很可能比今天低得多。
鈾-238通常發生α衰變(有時也會進行自發裂變),其衰變鏈被稱為鈾衰變系。該衰變系包含18種核素,最終的產物則是穩定核素鉛-206,整個衰變鏈由多種衰變途徑組成。[10]
鈾-235的衰變鏈被稱為錒衰變系,其中有15種核素,最終產物是穩定的鉛-207。[10]由於這些衰變系的衰變速率是不變的,因此有助於對比母子原子核的豐度,從而進行放射性定年法。
鈾-234也屬於鈾衰變系中的一員,因此它會最終衰變為鉛-206。
鈾-233是通過在核反應爐中對釷-232進行中子撞擊而形成的。鈾-233是可裂變物質,[9]其衰變系的最後一種核素為鉈-205。
鈾-235在核反應爐和核武器中有著十分重要的作用,因為它是自然界中唯一一種大量存在的可裂變鈾同位素。它能夠在熱中子撞擊下,分裂成多個碎片,從中釋放出可用的能量。[10]
鈾-238不可裂變,但則是可轉換同位素,能夠經中子活化變為可裂變的鈈-239。鈾-238可吸收一顆中子,形成鈾-239。239U會經β衰變成為錼-239,並在幾天內再β衰變為鈈-239。239Pu是三位一體核試中世界首個原子彈所使用的可裂變物質。[31]
濃縮鈾

自然界中的鈾是由99.2742%的鈾-238和0.7204%的鈾-235組成的。同位素分離過程將可裂變的鈾-235的濃度提高,以產生核武器和發電所用的濃縮鈾。鈾-235原子裂變所釋放的中子會被其他鈾-235原子吸收,促發更多的裂變反應,持續核連鎖反應。達到核連鎖反應所需的鈾-235質量稱為臨界質量。
濃縮鈾的鈾-235含量一般介乎3%到5%。[51]濃縮過程會產生大量不含鈾-235的物質,稱為貧鈾。貧鈾中鈾-235的含量不超過0.3%。[52]鈾的價格從2001年至2007年不斷上升,使鈾-235含量超過0.35%的鈾重新進行濃縮過程。貧六氟化鈾的價格因此從2001的每公斤5美元升至2007年的130美元以上。[52]
最常用的鈾濃縮方法是氣體離心法,即利用235UF6和238UF6分子量上的差異,把含有鈾-235的六氟化鈾離心分離出來。[27]氣體擴散法是人們最先使用的濃縮方法,曾用於美國曼哈頓計劃。該方法將六氟化鈾重復透過銀鋅薄膜擴散,利用同位素間擴散率的不同分離出鈾-235(鈾-238的原子量更高,因此擴散率較低)。[27]分子激光同位素分離法用具有特定能量的激光束把鈾-235與氯之間的分子鍵斷開,但保留鈾-238與氯間的鍵合。鈾-235便能以金屬態從溶液中沉澱分離出來。[6]原子蒸氣激光同位素分離法(AVLIS)使用的則是發出可見光的可調激光器,如染料激光器等。[53]另一種濃縮方法為液態熱擴散法。[8]
存量
生物及非生物存量

鈾是一種天然元素,在各類岩石、土壤和水裏都會少量出現。在地球的地殼當中,鈾的豐度在所有元素中排列第51。鈾也是在地球上大量存在的元素中原子序最高的。與所有原子量大於鐵的元素一樣,鈾只能在超新星爆炸中自然產生。[54]地幔的熱量主要來自當中鈾、釷和鉀-40的衰變。[55][56]這一熱量使得地球的外核保持液態,也推動著地幔對流,從而導致板塊移動。
鈾在地殼中的平均含量為百萬分之2至4,[8][43]約為銀的40倍。[10]從地表至地底25公里一層內,估計含有1017 kg鈾,而海洋裏則可能有1013 kg鈾。[8]泥土中鈾的含量為百萬分之0.7至11(由於使用磷肥料,農田土壤中鈾濃度可高達百萬分之15),在海中則是十億分之3。[43]
鈾的含量比銻、錫、鎘、汞和銀要高,並和砷和鉬相約。[9][43]數百種礦石都含有鈾,如瀝青鈾礦(最常見的鈾礦石)、釩酸鉀鈾礦、鈣鈾雲母、矽鈣鈾礦、銅鈾雲母、水矽鈾礦等等。[9]一些其他物質裏也有明顯較高的鈾含量,如磷礦石、褐煤、獨居石等。[9]一些加工廠能夠從含鈾量低至0.1%的物質中提取出鈾。[10]
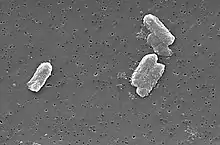
腐敗希瓦菌和鐵還原地桿菌等的某些細菌可以將鈾(VI)還原成鈾(IV)。[57]某些生物,如地衣Trapelia involuta和微生物檸檬酸桿菌能夠使內部鈾濃度比周圍環境高300倍。[58]檸檬酸桿菌在甘油磷酸(或其他類似的有機磷酸化合物)存在的情況下,可吸收鈾酰(UO2+
2)離子。在一天以後,一克細菌可以產生9克磷酸鈾酰晶體。這意味著可以用這一些物種對受到核污染的水源進行生物修復。[23][59]
自然界中的鈾(VI)在鹼性環境下會形成可溶性很高的碳酸鹽配合物。這使得核廢料中的鈾能夠輕易流動至地下水源和泥土中,對環境造成污染破壞。然而在鹼性環境下,當存在過量碳酸鹽時,很難將鈾以磷酸鈾的形式沉澱出來。[60]
植物會從泥土中吸取部分鈾。如果去水後以重量計,那鈾在植物中的含量為十億分之5至60,而木材燃燒後的灰燼中可含有百萬分之4的鈾。[23]食用植物中,鈾的去水重量比一般較低。人類每天從食物中吸收1至2微克的鈾。[23]
採礦與生產


2010年世界鈾產量為53,663噸,其中17,803噸(33.2%)採自哈薩克斯坦。其他主要鈾生產國還包括:加拿大(9,783噸)、澳洲(5,900噸)、納米比亞(4,496噸)、尼日爾(4,198噸)和俄羅斯(3,562噸)。[61]
开採鈾礦的方法包括:露天开採、地下开採、原地浸出和鑽孔开採等。[6]开採出的低濃度鈾礦包括0.01至0.25%的氧化鈾,經複雜的過程可從中提煉出鈾金屬。[62]採自加拿大薩斯喀徹溫阿薩巴斯卡盆地礦藏的高濃度鈾平均可含有高達23%的氧化鈾。[63]鈾礦石要壓碎至粉末狀,再經酸或鹼浸濾。浸濾液需通過沉澱、溶液萃取和離子交換,形成一種稱為「黃餅」的鈾精礦,含有至少75%氧化鈾(U3O8)。黃餅要經煅燒以移除磨粉過程中的雜質,再送往精煉和化學轉換工序。[64]
用鹼金屬或鹼土金屬對鹵化鈾進行還原反應,可製成商用鈾。[9]KUF
5或UF
4點解後,溶於熔化的氯化鈣(CaCl
2)和氯化鈉(NaCl)溶液中,也可產生鈾金屬。[9]鹵化鈾放在熱燈絲上經熱降解,可形成高純度鈾。[9]
資源儲備
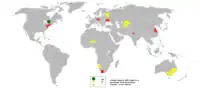
經估計,全球目前有550萬噸鈾庫存,每磅鈾可售59美元;[65]另有3500萬噸鈾尚待開採。[66]鈾價格從2003年5月的每磅10美元升至2007年7月的每磅138美元。這促使了人們對鈾的開採:[65]2005年世界為鈾開採花費2億美元,比2004年高出54%;[66]2006年世界花費7.74億美元,比2004年高出250%。[65]
澳洲擁有全球已知鈾礦藏的31%。[67]世界上最大的單個鈾礦藏並位於南澳州的奧林匹克大壩礦山。[68]中非共和國姆博穆省貝庫瑪也擁有大型鈾礦藏。
「百萬噸變百萬千瓦」等類似計劃通過拆卸核武器,將可用物質轉變為核燃料。[69]
海水中铀浓度很低,但蕴藏量巨大,约45亿吨,是陆地上已探明的铀矿储量的2000倍。1960年代後期,中國華東師範大學在世界上首次從海水中提取出公斤級的鈾。[70]1980年代,日本科學家證明,用離子交換法從海水萃取鈾元素在技術上是可行的。为此,日本已于1986年4月在香川县建成了年产10千克铀的海水提取厂。[71][72]科學家曾進行從海水中提取鈾的實驗,[73]但由於水中含有碳酸鹽,使鈾產量很低。2012年,美國橡樹嶺國家實驗室的研究人員宣佈成功研發了一種稱為HiCap的新型吸附劑,能比過去的吸附劑更好地保留固體或氣體分子、原子和離子。研究人員稱,這種材料提取出的鈾比過去多5至7倍。[74][75]
供應
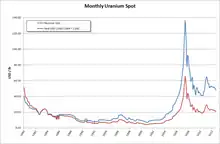
2005年共有17個國家生產高濃度氧化鈾,其中哈薩克斯坦(占全球產量的35.6%)和加拿大(16.7%)為最大產國,其他主要產國還包括澳洲(11.0%)、尼日爾(8.0%)、納米比亞(6.0%)、烏茲別克斯坦(5.5%)、俄羅斯(5.5%)、阿根廷(2.1%)、美國(2.8%)及中國(2.7%)等。[77]2004年国际原子能机构预计地球上的所有鈾礦藏估計足夠供應未來85年的需求,[66]但也有研究指出,20世紀末投資不足,可能對21世紀的鈾供應帶來壓力。[78]鈾礦藏量與礦石含鈾量呈對數正態分佈。礦石含鈾量降低10倍,可开採的鈾礦量就會提高300倍。[79]也就是說,礦石含鈾量越高,可開採量則越低,反之亦然。
應用
軍用
鈾在軍事方面的應用主要在於製造高密度穿甲弹。這種穿甲彈由貧鈾組成,並摻有1至2%其他元素,形成合金。在高速擊中目標時,由於其高密度、高硬度,並具有自燃性,它能夠有效摧毀重裝甲目標。坦克及其他車輛的裝甲中也有使用貧鈾。英、美及其他各國在波斯灣和巴爾幹作戰時使用了貧鈾軍備,由於可能在泥土中留下了鈾元素,因此引起了環境安全及政治上的爭論。[11]
貧鈾可用於製造儲存或運載放射性物質的容器外殼。雖然鈾本身具有放射性,但其高密度使它比鉛元素更有效於阻擋強烈的輻射,例如鐳所產生的輻射。[8]其他貧鈾的應用包括飛機控製面的平衡物以及導彈進入大氣層時的壓載和保護性外殼。[9]由於密度極高,貧鈾可用在慣性導航系統和陀螺儀式指南針當中。[9]貧鈾比其他同樣高密度的物質優勝,因為其加工、鑄造簡單,價格相對也較低。[43]接觸貧鈾時的主要危險在於氧化鈾中毒,而非輻射(鈾是一種弱α粒子射源)。
在第二次世界大戰晚期和整個冷戰期間,多國利用鈾-235作為可裂變爆炸物製造核武器。最初製成的有兩種核彈:第一種使用鈾-235,相對簡單;另一種使用經轉化鈾-238形成的鈈-239。之後生產的為更複雜,爆炸力也更大的裂變聚變核彈(氫彈),使用鈈裝置使氚氘混合物進行核聚變。這種核彈的外殼是不可裂變的鈾(即貧鈾),核聚變產生的快中子使該物質裂變,產生爆炸中超過一半的能量。[80]
民用


鈾在民間主要在核電站中作核燃料用。假設完全裂變,一公斤的鈾-235理論上可以產生80萬億焦耳的能量(8×1013焦耳),相等於3000噸煤。[6]
商業核電站所用的鈾一般含有3%的鈾-235同位素。[6]CANDU和Magnox反應爐是能夠使用非濃縮鈾作為燃料的僅有的兩種反應爐。美國海軍所用的核反應爐通常使用高濃縮鈾,鈾-235的比例較高(實際百分比被列為機密)。快中子增殖反應堆可經過以下反應將鈾-238轉化為鈈:[9] 238U (n, γ) → 239U -(β) → 239Np -(β) → 239Pu.
在放射性被發現之前,鈾主要被用在黃色玻璃及陶器彩釉當中,如鈾玻璃等。
瑪莉·居禮在鈾礦石(瀝青鈾礦)中發現並分離出鐳元素,激發了人們對鈾礦進行開採,將提取出的鐳製成螢光油漆,用於鐘表和飛機儀表盤上。[81]由於要處理3噸鈾礦才能提取出1克鐳,這產生了大量的含鈾副產品。這些副產品都送往彩釉工業,使得含鈾彩釉的價格大大降低。除了陶器以外,鈾還被用在瓦片中,可製成紅、藍、綠、黃、紫紅、黑等多種顔色。
鈾也被用在攝影學化學物(特別是用作調色劑的硝酸鈾)、[9]燈絲以及皮革、木材的染料當中。鈾鹽可作為絲綢和樣貌的媒染劑。乙酸鈾酰和甲酸鈾酰在透射電子顯微鏡中被用作富含電子的染料,在為超薄切片、單獨細胞器和高分子成像時,及在對病毒進行負染色法時提高標本與環境的對比度。
鈾的放射性的發現促進了更多在科學及日常中對鈾的應用。由於鈾-238同位素的半衰期很高(4.51×109年),因此被用來估計最遠古火成岩的年齡。其他用到鈾的放射性定年法包括鈾釷定年法、鈾鉛定年法和鈾鈾定年法。在產生高能X射線時所用的目標體中也用到鈾。[9]
安全
人類吸入受污染空氣或攝入受污染的水和食物,鈾(及其衰變產物,如氡等)就會進入人的體內。空氣中的鈾通常非常少,但在磷化肥處理廠、核武器研究中心、煤發電廠、鈾礦、鈾礦石和濃縮鈾處理廠中工作的人員,以及居住在曾使用貧鈾作為武器的戰地附近的人,就會有較高的鈾攝入量。[82][83]位於地底鈾礦藏上的房屋建築中會有較多的放射性氡氣。
中華民國勞動部職業安全衛生署訂定八小時的工作天內,工作場所鈾的濃度在0.25 mg/m3為可接受的範圍,而美國國家職業安全衛生研究所則建議八小時工作天內暴露濃度不應超過0.25 mg/m3,短時間內則不可超過0.6 mg/m3,而在10 mg/m3的濃度下,鈾有立即的危險性。
大部分進食到體內的鈾會在消化過程後排出。當氧化鈾等不可溶的含鈾物質進入身體後,只有大約0.5%會被吸收;如果可溶性較高的鈾醯離子進入體內,身體所吸收的量可以高達5%。[23]不過,可溶的比不可溶的铀化合物能夠更快地離開身體,特別是當不可溶鈾化合物經塵埃進入肺部之後,會對人體造成更大的傷害。在進入血液後,鈾會因親磷性而積累在骨骼組織內,並停留多年。[23]人的皮膚不會吸收鈾,且鈾所釋放的α粒子也無法穿透皮膚。
合成的鈾則會形成鈾離子,並會累積於骨骼、肝、腎、以及生殖器官之組織。鈾可被鋼表面或含水層給淨化。
影響
留在體內的鈾會影響腎、腦、肝、心的正常運作,除了微弱放射性以外,其本身的化學毒性也會對身體的其他器官造成傷害。[23][84][85]鈾是一種生殖毒物。[86][87]因為鈾-238主要釋放的α輻射具有較小的穿透範圍,所以放射性只會對小部分組織造成影響。三氧化鈾、硝酸铀酰及其他六價铀化合物中的鈾醯(UO2+
2)離子在實驗動物身上,造成了先天缺陷和免疫系統破壞。[88]美國疾病控制與預防中心曾發表過研究指出,天然及貧鈾仍沒有造成過人類癌症個案,[89]但是鈾及其衰變產物(特別是氡)對人體健康有極大的威脅。[43]曝露在鈾下不代表暴露在其核分裂產物鍶-90、碘-131的風險下,但在製藥過程、核反應爐、或核爆現場就有暴露在其下的危險。[90]
雖然暴露在高濃度的六氟化铀對人體有致命性的傷害,但死因通常為氢氟酸以及氟化铀酰的產生,而不是鈾本身的毒性。[91]鈾金屬的小碎片有易燃的風險,而鈾金屬粉末甚至可以在室溫下在空氣中自燃,造成火災。[9]
研究人員在接觸鈾金屬時,都會使用手套作保護。[92]在處理及存放含鈾度高的物質時,須避免意外攝入。[92]
| 器官系統 | 症狀 | 生理功能異常 | 實驗研究 |
|---|---|---|---|
| 腎 | 提高尿中尿蛋白、過氧氫化酶濃度以及利尿 | 對腎小管造成傷害、管上皮細胞與腎元細胞壞死 | N/A |
| 腦/中樞神經系統 | 認知神經測試表現失常 | 急性膽鹼能神經中毒
大腦皮質、中腦、蚓部產生依賴性累積 、海馬迴電生理異常 |
N/A |
| DNA | 癌症病例增加[48][93][94][95][96][97] | 基因突變率增加、腫瘤數目增加 | 出現具微核的雙核細胞,抑制細胞週期及增殖、姊妹染色體異常增生、基因具致癌表現型 |
| 骨骼/肌肉 | N/A | 牙周之骨骼生成及肺泡傷害復原受抑制 | N/A |
| 生殖系統 | 鈾礦礦工之第一胎多為女性 | 睪丸間質內細胞空化 | N/A |
| 呼吸系統 | 目前未證實有不利之影響 | 嚴重的鼻塞及鼻出血、肺病變、纖維化、水腫、癌 | N/A |
| 腸胃 | 嘔吐、腹瀉、尿蛋白 | N/A | N/A |
| 肝 | 未發現在暴露劑量下有影響 | 脂肪肝、侷限性壞死 | N/A |
| 皮膚 | 尚未有暴露劑量評估之數據 | 空化表皮細胞腫脹、毛囊及皮脂腺受損 | N/A |
| 嵌入體內之貧鈾碎片周圍組織 | 含鈾尿濃度提高 | 含鈾尿濃度提高、神經心理測驗及生化測試異常 | N/A |
| 免疫系統 | 慢性疲勞、皮疹、眼耳感染、髮量降低、體重減輕、咳嗽,可能是鈾之化合物之影響,而非貧鈾本身 | N/A | N/A |
| 眼 | N/A | 結膜炎、刺激性發炎、水腫、結膜囊潰瘍 | N/A |
| 血液 | N/A | 紅血球數量、血紅素含量降低 | N/A |
| 心血管 | 因攝入鈾所導致之心肌炎、攝入後六月即痊癒 | 無影響 | N/A |
參見
- 各國鈾儲備量列表
- 核工程
- 核燃料循環
- 原子核物理學
参考文献
- Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. . Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- Morss, L.R.; Edelstein, N.M. and Fuger, J. (编). 3rd. Netherlands: Springer. 2006. ISBN 9048131464.
- . Guinness World Records. [2019-12-30]. (原始内容存档于2021-05-16) (英国英语).
- . [2012-03-14]. (原始内容存档于2011-01-19).
- . Lawrence Berkeley National Laboratory, Berkeley, US. (原始内容存档于2007-04-27).
- Emsley 2001,第479頁.
- "U.S. to pump money into nuke stockpile, increase security," (页面存档备份,存于) RIA Novosti 18 February 2010
- . 5th. The McGraw-Hill Companies, Inc. ISBN 0-07-142957-3.
- Hammond, C. R. (PDF). CRC press. 2000 [2013-07-23]. ISBN 0-8493-0481-4. (原始内容 (PDF)存档于2008-06-26).
- . 6th. Columbia University Press. [2013-07-23]. (原始内容存档于2011-07-27).
- . . The Gale Group, Inc. [2013-07-23]. (原始内容存档于2011-07-27).
- Rollett, A. D. . John Wiley and Sons. 2008: 108. ISBN 0-470-40835-9.
- Seaborg 1968,第779頁.
- . Argonne National Laboratory. [2007-02-18]. (原始内容存档于2006-09-22).
- Seaborg 1968,第778頁.
- Greenwood, Norman Neill; Earnshaw, Alan. . 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- (简体中文)唐任寰等. 第一版. 北京: 科学出版社. 1990. ISBN 9787030305725.
- Puigdomenech, Ignasi Hydra/Medusa Chemical Equilibrium Database and Plotting Software (2004) KTH Royal Institute of Technology, freely downloadable software at . [2007-09-29]. (原始内容存档于2007-09-29).
- Seaborg 1968,第782頁.
- Seaborg 1968,第780頁.
- . Office of Civilian Radioactive Waste Management. [2006-06-28]. (原始内容存档于2004-06-03).
- Emsley 2001,第482頁.
- Emsley 2001,第477頁.
- Klaproth, M. H. . Chemische Annalen. 1789, 2: 387–403.
- . 4th. Houghton Mifflin Company. [2013-07-23]. (原始内容存档于2011-07-27).
- Péligot, E.-M. . Annales de chimie et de physique. 1842, 5 (5): 5–47 [2013-07-23]. (原始内容存档于2010-08-22).
- Emsley 2001,第478頁.
- Curie, M. [Rays emitted by compounds of uranium and thorium]. Comptes Rendus. 1898, 126: 1101–1103. OL 24166254M (法语).
- Schmidt, G. C. [On the radiation emitted by thorium and thorium compounds]. Verhandlungen der Physikalischen Gesellschaft zu Berlin. 1898, 17: 14–16 (德语).
- Schmidt, G. C. [On the radiation emitted by thorium compounds and some other substances]. Annalen der Physik und Chemie. 1898, 65 (5): 141–151 [2023-09-13]. Bibcode:1898AnP...301..141S. doi:10.1002/andp.18983010512. (原始内容存档于2021-04-28) (德语). (modern citation: Annalen der Physik, vol. 301, pp. 141–151 (1898)).
- Seaborg 1968,第773頁.
- Fermi, Enrico. (PDF). Royal Swedish Academy of Sciences. 1938-12-12 [2013-07-23]. (原始内容存档 (PDF)于2018-08-09).
- De Gregorio, A. . Nuovo Saggiatore. 2003, 19: 41–47. Bibcode:2003physics...9046D. arXiv:physics/0309046
 .
. - Nigro, M. (PDF). 2004 [2009-05-05]. (原始内容存档 (PDF)于2009-03-25).
- van der Krogt, Peter. . [2009-05-05]. (原始内容存档于2010-01-23).
- Meitner, L. and Frisch, O. . Nature. 1939, 143 (5218): 239–240 [2013-07-23]. Bibcode:1969Natur.224..466M. doi:10.1038/224466a0. (原始内容存档于2009-08-13).
- Walsh, John. (PDF). Science (AAAS). 19, 212: 1369–1371 [2013-03-23]. ISSN 0036-8075. (原始内容 (PDF)存档于2013-06-29).
- Helmreich, J.E. Gathering Rare Ores: The Diplomacy of Uranium Acquisition, 1943–1954, Princeton UP, 1986: ch. 10 ISBN 978-0-7837-9349-8
- . U.S. Department of Energy, Argonne National Laboratory. 2012 [2012-07-25]. (原始内容存档于2021-04-18).
- . U.S. Department of Energy, Argonne National Laboratory. 1998 [2007-01-28]. (原始内容存档于2006-09-26).
- . U.S. Department of Energy, Argonne National Laboratory. 2012 [2012-07-25]. (原始内容存档于2012-06-22).
- . U.S. Department of Energy, Argonne National Laboratory. 2012 [2012-07-25]. (原始内容存档于2012-06-22).
- Emsley 2001,第480頁.
- Warneke, T.; Croudace, I. W.; Warwick, P. E. and Taylor, R. N. . Earth and Planetary Science Letters. 2002, 203 (3–4): 1047–1057. Bibcode:2002E&PSL.203.1047W. doi:10.1016/S0012-821X(02)00930-5.
- Newtan, Samuel Upton (2007). Nuclear War I and Other Major Nuclear Disasters of the 20th Century, AuthorHouse ISBN 978-1-4259-8512-7.
- . Time.com. 2009-03-25 [2010-05-24]. (原始内容存档于2013-08-26).
- Gilliland, Frank D. MD; Hunt, William C. MS; Pardilla, Marla MSW, MPH; Key, Charles R. MD, PhD. . Journal of Occupational & Environmental Medicine. March 2000, 42 (3): 278–283 [2013-07-23]. PMID 10738707. doi:10.1097/00043764-200003000-00008. (原始内容存档于2020-03-08).
- Brugge, Doug; Goble, Rob. . American Journal of Public Health (Ajph.org). 2002, 92 (9): 1410–9. PMC 3222290
 . PMID 12197966. doi:10.2105/AJPH.92.9.1410.
. PMID 12197966. doi:10.2105/AJPH.92.9.1410. - Glaser, Alexander and von Hippel, Frank N. . Scientific American. February 2006, 294 (2): 56–63 [2013-07-23]. PMID 16478027. doi:10.1038/scientificamerican0206-56. (原始内容存档于2013-12-03).
- Seaborg 1968,第777頁.
- . Argonne National Laboratory. [2007-02-11]. (原始内容存档于2007-01-24).
- Diehl, Peter. . Laka Foundation. [2009-07-31]. (原始内容存档于2013-01-13).
- Duarte, F. J. and Hillman, L. W. (编). . Academic. 1990: 413. ISBN 0-12-222700-X. (原始内容存档于2010-09-17).
- . NASA. [2013-01-01]. (原始内容存档于2021-05-16).
- Biever, Celeste. . New Scientist. 2005-07-27 [2013-07-23]. (原始内容存档于2015-06-11).
- . physicsweb. 2003-05-07 [2007-01-14]. (原始内容存档于2012-01-13).
- Min, M; Xu, H; Chen, J; Fayek, M. . Ore Geology Reviews. 2005, 26 (3–4): 198. doi:10.1016/j.oregeorev.2004.10.003.
- Emsley 2001,第476 and 482頁.
- Macaskie, L. E.; Empson, R. M.; Cheetham, A. K.; Grey, C. P. and Skarnulis, A. J. . Science. 1992, 257 (5071): 782–784. Bibcode:1992Sci...257..782M. PMID 1496397. doi:10.1126/science.1496397.
-
Nilgiriwala, K.S.; Alahari, A.; Rao, A. S. and Apte, S.K. . Applied and Environmental Microbiology. 2008, 74 (17): 5516–5523. PMC 2546639
 . PMID 18641147. doi:10.1128/AEM.00107-08.
. PMID 18641147. doi:10.1128/AEM.00107-08. - . World Nuclear Association. [2010-06-11]. (原始内容存档于2018-12-26).
- Seaborg 1968,第774頁.
- . [2009-09-04]. (原始内容存档于2010-06-12).
- Gupta, C. K. and Mukherjee, T. K. . CRC Press. 1990: 74–75. ISBN 0-8493-6804-9.
- . World-nuclear-news.org. [2008-09-12]. (原始内容存档于2020-05-26).
- . International Atomic Energy Agency. 2006 [2007-03-29]. (原始内容存档于2014-08-05).
- . [2013-07-23]. (原始内容存档于2008-05-09).
- . South Australian Chamber of Mines and Energy. 2002 [2007-01-14]. (原始内容存档于2012-01-06).
- . World-nuclear.org. [2010-05-24]. (原始内容存档于2013-02-24).
- . [2016-06-22]. (原始内容存档于2021-02-17).
- . Japan Atomic Energy Research Institute. 1999-08-23 [2008-09-03]. (原始内容存档于2009-10-17).
- . 1996-02-12 [2007-03-29]. (原始内容存档于2007年4月10日).
- Tsezos, M.; Noh, S. H. . The Canadian Journal of Chemical Engineering (Wiley-Blackwell). 1984, 62 (4): 559–561. ISSN 0008-4034. doi:10.1002/cjce.5450620416.
- . Oak Ridge National Laboratory, United States. 2012-08-21 [2013-02-22]. (原始内容存档于2012-08-25).
- . Pnnl.gov. 2012-08-21 [2013-02-22]. (原始内容存档于2012-08-25).
- . (原始内容存档于12 十二月 2007).
- . World Nuclear Association. [2013-07-21]. (原始内容存档于2016-01-23).
- . Massachusetts Institute of Technology. 2007-03-21 [2007-03-29]. (原始内容存档于2013-11-05).
- Deffeyes, Kenneth S. and MacGregor, Ian D. . Scientific American: 66. January 1980 [2008-04-21]. (原始内容存档于2013-07-28).
- . Federation of American Scientists. 1998 [2007-02-19]. (原始内容存档于2010-12-29).
- . Newscientist.com. [2008-09-12]. (原始内容存档于2014-08-15).
- . U.S. Environmental Protection Agency. [2009-07-31]. (原始内容存档于2015-09-07).
- . Agency for Toxic Substances and Disease Registry. September 1999 [2007-02-18]. (原始内容存档于2007-02-20).
- Craft, E. S.; Abu-Qare, A. W.; Flaherty, M. M.; Garofolo, M. C.; Rincavage, H. L. & Abou-Donia, M. B. (PDF). Journal of Toxicology and Environmental Health Part B: Critical Reviews. 2004, 7 (4): 297–317 [2019-12-25]. CiteSeerX 10.1.1.535.5247
 . PMID 15205046. doi:10.1080/10937400490452714. (原始内容存档 (PDF)于2011-07-23).
. PMID 15205046. doi:10.1080/10937400490452714. (原始内容存档 (PDF)于2011-07-23). - (PDF). Atlanta, GA: Agency for Toxic Substances and Disease Registry (ATSDR). September 1999 [2013-07-23]. CAS# 7440-61-1. (原始内容存档 (PDF)于2011-09-27).
- Hindin, Rita; Brugge, D.; Panikkar, B. . Environ Health. 2005, 4: 17. PMC 1242351
 . PMID 16124873. doi:10.1186/1476-069X-4-17.
. PMID 16124873. doi:10.1186/1476-069X-4-17. - Arfsten, D.P.; K.R. Still; G.D. Ritchie. . Toxicology and Industrial Health. 2001, 17 (5–10): 180–91. PMID 12539863. doi:10.1191/0748233701th111oa.
- Domingo, J. L.; Paternain, J. L.; Llobet, J. M.; Corbella, J. . Toxicology. 1989, 55 (1–2): 143–52. PMID 2711400. doi:10.1016/0300-483X(89)90181-9.
- . CDC. [2007-02-15]. (原始内容存档于2021-02-08).
- Chart of the Nuclides, US Atomic Energy Commission 1968
- Dart, Richard C. . Lippincott Williams & Wilkins. 2004: 1468. ISBN 978-0-7817-2845-4.
- . Washington State Department of Health, Office of Radiation Protection. 2010 [2011-08-23]. (原始内容存档于2011-09-28).
- Mulloy KB; James DS; Mohs K; Kornfeld M. . Environ Health Perspect. 2001, 109 (3): 305–309. PMC 1240251
 . PMID 11333194. doi:10.1289/ehp.01109305.
. PMID 11333194. doi:10.1289/ehp.01109305. - Samet JM; Kutvirt DM; Waxweiler RJ; Key CR. . N Engl J Med. 1984, 310 (23): 1481–1584. PMID 6717538. doi:10.1056/NEJM198406073102301.
- Dawson, Susan E. (PDF). Human Organization. 1992, 51 (4): 389–397 [2019-12-25]. doi:10.17730/humo.51.4.e02484g513501t35. (原始内容存档 (PDF)于2013-07-19).
- Gilliland FD; Hunt WC; Pardilla M; Key CR. . J Occup Environ Med. 2000, 42 (3): 278–283. PMID 10738707. doi:10.1097/00043764-200003000-00008.
- Gottlieb LS; Husen LA. . Chest. 1982, 81 (4): 449–52. PMID 6279361. doi:10.1378/chest.81.4.449.
书籍
- Emsley, John. . . Oxford: Oxford University Press. 2001: 476–482. ISBN 0-19-850340-7.
- Seaborg, Glenn T. . . Skokie, Illinois: Reinhold Book Corporation. 1968: 773–786. LCCCN 68-29938.
外部連結
| 维基词典中的词条「」。 |
| 维基共享资源上的相关多媒体资源:鈾 |
- 元素鈾在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— 鈾(英文)
- 元素鈾在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素鈾在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 鈾(英文)
- 美國能源部有關鈾輻射的資料 (页面存档备份,存于)
- 世界原子能協會:「鈾是甚麼?」 (页面存档备份,存于)
- 鈾目前的市場價格 (页面存档备份,存于)
- 全球鈾礦藏地圖
- 美國國家醫學圖書館有害物質數據庫——鈾 (页面存档备份,存于)
- Uranium (页面存档备份,存于) at The Periodic Table of Videos (University of Nottingham)