氢氧根
氫氧離子,旧称沎[1][2],化學符號為OH-。其中氢和氧之间以共价键连接,整体带一单位的负电荷。常常與不同的元素組成氫氧化物。
| 氢氧离子 | |
|---|---|
 | |
 | |
| 别名 | 氢氧離子 |
| 识别 | |
| CAS号 | 14280-30-9 |
| ChemSpider | 936 |
| SMILES |
|
| InChI |
|
| ChEBI | 16234 |
| 性质 | |
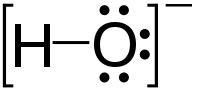
| 化学式 | OH− |
| 17.00737(7) g·mol⁻¹ | |
| 外观 | 以水合离子形式存在, 无特征颜色 |
| pKa | ~22 |
| pKb | -1.74 15.74 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
命名
解離
一般電解質解離
氫氧根在電解質的解離中占有很重要的地位,首先,因為水在25℃時會解離成氫離子和氫氧根,其體積莫耳濃度皆為10-7mol/L。解離式為:
同時,所有電解質在25℃時,解離後氫離子的體積莫耳濃度(記為[H+])與氫氧根的體積莫耳濃度(記為[OH-])相乘,必為10-14mol2/L2。
鹼性電解質解離
含有氫氧根的鹼性電解質,亦遵守在25℃時,[H+][OH-]=10-14mol2/L2。鹼性電解質,一般會解離出比較多的OH-。且電解質會影響水本身的解離,最後[H+][OH-]=10-14mol2/L2依然成立。用解離後[OH-]=10-3mol/L的氫氧化鈉舉例:
10-7(原水的[H+])乘10-7(原水的[OH-])+10-3(氫氧化鈉的[OH-])→水受到影響,降低解離→10-11(後水的[H+])乘10-11(後水的[OH-])+10-3(氫氧化鈉的[OH-])→10-11乘10-3→10-14
一般,水的部分的解離會被忽略,不過亦有例外:當鹼性電解質解離後的[OH-]≤10-7mol/L時。
參考與註釋
- 狄考文. . 益智書會. 1901年.
- 王扬宗. . 《中国科技史料》1991年 第2期 (中国科学院自然科学史研究所).
- ,為了要使其為穩定的化合物,故A的價數必為正。
- . [2011-04-18]. (原始内容存档于2012-01-18).,因為OH為價數為負,故置於後。
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.