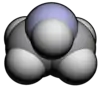
氮丙环
氮丙环,也称环乙亚胺、氮杂环丙烷、吖丙啶、环乙胺、氮丙啶、乙烯亚胺,是氮原子取代环丙烷的一个碳原子形成的杂环化合物,分子式为C2H5N。[1][2]氮丙环在室温下是无色易流动的液体,有强烈的氨味,有毒。它用作有机合成的中间体,也是很多合成药物的前体。
| 氮丙环 | |||
|---|---|---|---|
| |||
| IUPAC名 Aziridine | |||
| 别名 | 环乙亚胺 氮杂环丙烷 吖丙啶 乙基亚胺 环乙胺 氮三环 乙撑亚胺 环氮乙烷 氮丙啶 乙烯亚胺 环丙啶 | ||
| 识别 | |||
| CAS号 | 151-56-4 | ||
| ChemSpider | 8682 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | NOWKCMXCCJGMRR-UHFFFAOYAE | ||
| EINECS | 205-793-9 | ||
| ChEBI | 30969 | ||
| KEGG | C11687 | ||
| 性质 | |||
| 化学式 | C2H5N | ||
| 摩尔质量 | 43.07 g·mol−1 | ||
| 外观 | 无色有强烈氨味的液体 | ||
| 密度 | 0.832 g/mL, 24/4 °C | ||
| 沸点 | 55~56 °C | ||
| 溶解性(水) | 混溶 | ||
| 溶解性(醇和醚) | 可溶 | ||
| 危险性 | |||
| 警示术语 | R:R11, R23/24/25, R34, R45, R46, R50/53 | ||
| 安全术语 | S:S45, S53, S61 | ||
| 欧盟分类 | |||
| 主要危害 | 有毒 | ||
| 闪点 | -11 °C | ||
| 自燃温度 | 322 °C | ||
| 爆炸極限 | 3.6–46% | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
氮丙环在国际癌症研究机构(IARC)的分类中属于2B类致癌物质,可能会造成癌症。
广义上,氮丙环指任何含有简单环丙啶环系(三元氮杂环丙烷环系)的化合物,即简单氮丙环的衍生物。
结构
与其他三元环体系如环丙烷、环氧乙烷类似,氮丙环中的键角约为60°,与sp3杂化碳的109°28'相差较大,含有香蕉键。它有碱性,但不如非環系脂肪族胺化合物强,pKa为7.9。氮丙環中的角張力還能增高氮反轉的能壘(能量障壁)。這個能壘的高度允許分隔其衍生物的反轉異構體的分離,例如N-氯-2-甲基氮丙环的順-和反-反转异构体。
合成
氮丙环可通过多种方法合成。
反应
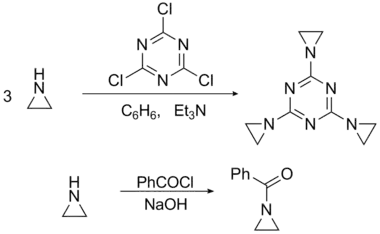
氮丙环的氮类似于仲胺,可在不开环的情况下发生取代反应。与三聚氰氯的产物三乙烯三聚氰胺可在感光材料中用作坚膜剂:
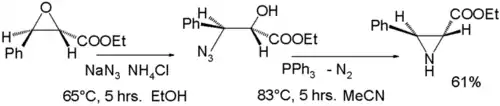
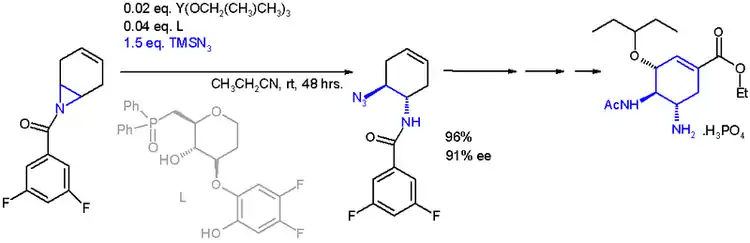
氮丙环易与亲核试剂反应开环,其中醇解和氨解反应是相应制备反应的逆反应。与有机锂试剂和吉尔曼试剂等碳亲核试剂也可反应。此类的反应有很多应用,如在奥司他韦全合成中,有一步利用了氮丙环环在叠氮三甲基硅烷(TMSN3)和不对称配体作用下的不对称开环反应:[10]
一些N-取代且两个环碳原子都连有吸电子基的氮丙环光解电环化开环生成亚甲胺叶立德,并可被特定的亲偶极体捕集,发生1,3-偶极环加成反应。
很多氮丙环衍生物都是药物,包括噻替哌、三乙烯三聚氰胺和三乙烯亚胺苯醌。噻替哌是一种抗癌药物,可由三氯化磷与硫反应先制得三氯硫磷,再与三分子的氮丙环反应合成。
氮丙烯是在氮丙环分子中加上一个双键形成的化合物,有两种,双键为C=N键的称为“1-氮丙烯”,双键为C=C键的称为“2-氮丙烯”。氮丙烯母体尚未发现,1-氮丙烯的衍生物已有报导。另外,将氮丙环的氮换为氧和硫,则可分别得到环氧乙烷与环硫乙烷(噻丙环),性质与氮丙环有些相似。
参考资料
- Heterocyclic chemistry T.L. Gilchrist ISBN 0-582-01421-2
- Epoxides and aziridines - A mini review Albert Padwaa and S. Shaun Murphreeb Arkivoc (JC-1522R) pp 6-33 Online article (页面存档备份,存于)
- . [2008-06-30]. (原始内容存档于2008-04-24).
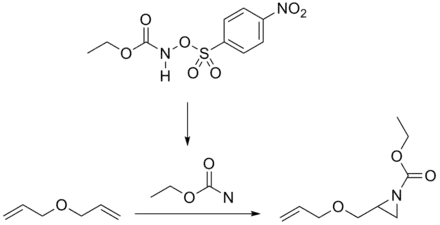
- Addition reactions of ethoxycarbonylnitrene and ethoxycarbonylnitrenium ion to allylic ethers M. Antonietta Loreto, Lucio Pellacani, Paolo A. Tardella, and Elena Toniato Tetrahedron Letters, Volume 25, Issue 38, 1984, Pages 4271-4274 Abstract Archive.is的存檔,存档日期2012-09-09
- Readily Available Unprotected Amino Aldehydes Ryan Hili and Andrei K. Yudin J. Am. Chem. Soc.; 2006; 128(46) pp 14772 - 14773; (Communication) doi:10.1021/ja065898s
- Hoch, Compt. rend., 196, 1865 (1934); (a), ibid., aOS, 799 (1936); (e), ibid., 204, 358 (1937).
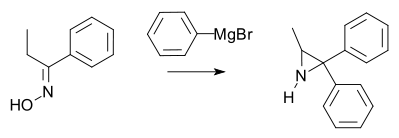
- The action of Grignard reagents on oximes. i. The action of phenylmagnesium bromide on mixed ketoximes Kenneth N. Campbell, James F. Mckenna J. Org. Chem.; 1939; 4(2); 198-205. doi:10.1021/jo01214a012
- The reaction of Grignard reagents with oximes. ii. The action of aryl grignard reagents with mixed ketoximes Kenneth N. Campbell, Barbara Knapp Campbell, Elmer Paul Chaput J. Org. Chem.; 1943; 8(1); 99-102. doi:10.1021/jo01189a015
- The action of Grignard reagents on oximes. iii. The mechanism of the action of arylmagnesium halides on mixed ketoximes. A new synthesis of ethyleneimines Kenneth N. Campbell, Barbara K. Campbell, James F. Mckenna, and Elmer Paul Chaput J. Org. Chem.; 1943; pp 103 - 109; doi:10.1021/jo01189a016
- De Novo Synthesis of Tamiflu via a Catalytic Asymmetric Ring-Opening of meso-Aziridines with TMSN3 Yuhei Fukuta, Tsuyoshi Mita, Nobuhisa Fukuda, Motomu Kanai, and Masakatsu Shibasaki J. Am. Chem. Soc.; 2006; 128(19) pp 6312 - 6313; Abstract (页面存档备份,存于)