四氯化钒
四氯化钒(化学式:VCl4)是钒(IV)的氯化物,为亮红色液体,可用于制备其他很多钒化合物,包括氯化二茂钒。它与许多配体形成加合物,如与四氢呋喃反应生成VCl4(THF)2。
| 四氯化钒 | |
|---|---|
 | |
| IUPAC名 Vanadium(IV) chloride | |
| 别名 | 氯化钒(IV) |
| 识别 | |
| CAS号 | 7632-51-1 |
| PubChem | 24273 |
| ChemSpider | 19956660 |
| InChI |
|
| InChIKey | UNUHYFVFMNJHJW-XBHQNQODAR |
| EINECS | 231-561-1 |
| RTECS | YW2625000 |
| 性质 | |
| 化学式 | VCl4 |
| 192.75 g·mol⁻¹ | |
| 外观 | 亮红色液体 对潮湿敏感 |
| 密度 | 1.816 g/cm³ (液) |
| 熔点 | −28 °C |
| 沸点 | 154 °C |
| 溶解性(水) | 分解 |
| 溶解性(其他溶剂) | 氯代烃 |
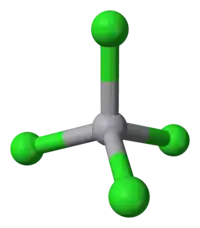
| 结构 | |
| 配位几何 | 四面体 |
| 偶极矩 | 0 D |
| 危险性 | |
| 警示术语 | R:14-23/24/25-34 |
| 安全术语 | S:26-27-36/37/39-45 |
| 主要危害 | 氧化剂 水解产生HCl |
| 相关物质 | |
| 相关化学品 | 四氯化钛、铬酰氯 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
四氯化钒呈顺磁性,它比反磁性的四氯化钛多一个价电子。它是少数室温下为液体且为顺磁性的化合物之一。
与同族的VF5、NbCl5和TaCl5不同,VCl4可由金属钒氯化制备,氯气的氧化性不足以将钒氧化至VCl5。此外,四氯化钒在沸点下分解,生成三氯化钒和氯气:
- 2 VCl4 → 2 VCl3 + Cl2
参考资料
- M. K. O’Brien, B. Vanasse, “Vanadium(IV) Chloride” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York.
- Calderazzo, F.; Maichle-Mossmer, C.; Pampaloni, G. and Strähle, J., "Low-temperature Syntheses of Vanadium(III) and Molybdenum(IV) Bromides by Halide Exchange", Journal of the Chemical Society, Dalton Transactions, 1993, pages 655-8.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.