氰化钡
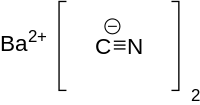
氰化钡(),化学式 Ba(CN)2,分子量为189.38,白色光亮鳞状结晶。不溶于水,微溶于乙醇,遇酸或露置空气中能吸收水分和二氧化碳分解出剧毒的氰化氢气体。[2]
| 氰化钡 | |
|---|---|
 | |
| 英文名 | |
| 识别 | |
| CAS号 | 542-62-1 |
| PubChem | 10961 |
| ChemSpider | 10496 |
| SMILES |
|
| InChI |
|
| InChIKey | UNLSXXHOHZUADN-UHFFFAOYAI |
| EINECS | 208-882-3 |
| 性质 | |
| 化学式 | Ba(CN)2 |
| 189.38 g·mol⁻¹ | |
| 外观 | 白色光亮鳞状结晶 |
| 溶解性(水) | 极易溶(800 g·l−1当14℃)[1] |
| 溶解性 | 微溶于乙醇 |
| 危险性 | |
| MSDS | MSDSMSDS |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
性质
氰化钡是一种吸湿性固体,会水合成二水合物 Ba(CN)2 · 2 H2O ,为棱柱结构。它在 100 °C 时会放出结晶水。[4] 当 Ba(CN)2 在水蒸气中加热时,会形成氢氧化钡 Ba(OH)2 、氨 NH3 和一氧化碳 CO。[4]
参考资料
- Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 49 (《氰化钡》在Google Books的內容。).
- Smith, R P; Gosselin, R E. . Annual Review of Pharmacology and Toxicology. 1976, 16: 189–99. PMID 779614. doi:10.1146/annurev.pa.16.040176.001201.
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Verlag S. Hirzel, Bd. 2, 1908. S. 258. Volltext
- Friedrich Konrad Beilstein: Beilsteins Handbuch der organischen Chemie. 1918, Verlag Edward Bros., 4. Auflage 1943, 1. Band, S. 243. Volltext
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.