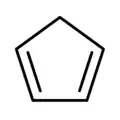
环戊二烯
环戊二烯(英語:),有时会称为茂[註 1]化氢(CpH)[註 2],是五个碳的环状二烯烃,分子式为C5H6。环戊二烯室温下为无色液体,具有强烈的刺激性气味。在室温时会发生狄尔斯-阿尔德反应,迅速聚合生成二聚环戊二烯,二聚体加热又可分解为环戊二烯。环戊二烯不溶于水,易溶于乙醚、苯等溶剂。 环戊二烯基可以简写为Cp。
| 环戊二烯 | |||
|---|---|---|---|
| |||
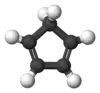 | |||
| 系统名 Cyclopenta-1,3-diene[1] 1,3-環戊二烯 | |||
| 别名 | 茂 | ||
| 识别 | |||
| 缩写 | CPD, HCp | ||
| CAS号 | 542-92-7 | ||
| PubChem | 7612 | ||
| ChemSpider | 7330 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | ZSWFCLXCOIISFI-UHFFFAOYAI | ||
| Beilstein | 471171 | ||
| Gmelin | 1311 | ||
| EINECS | 208-835-4 | ||
| ChEBI | 30664 | ||
| RTECS | GY1000000 | ||
| MeSH | 1,3-cyclopentadiene | ||
| 性质 | |||
| 化学式 | C5H6 | ||
| 摩尔质量 | 66.1 g·mol−1 | ||
| 外观 | 无色液体 | ||
| 密度 | 786 mg cm-3 | ||
| 熔点 | -90 °C(183 K) | ||
| 沸点 | 39-43 °C(312-316 K) | ||
| pKa | 16 | ||
| pKb | -2 | ||
| 结构 | |||
| 分子构型 | 平面型[2] | ||
| 热力学 | |||
| S⦵298K | 182.7 J K-1 mol-1 | ||
| 热容 | 115.3 J K-1 mol-1 | ||
| 危险性 | |||
欧盟危险性符号 易燃 F 易燃 F 有害 Xn 有害 Xn 危害环境N 危害环境N | |||
| 警示术语 | R:R11-R20/22-R36/37/38-R51/53 | ||
| 安全术语 | S:S2-S36/37-S61 | ||
GHS危险性符号   | |||
| GHS提示词 | 危险 | ||
| H-术语 | 225-301-311-332-371 | ||
| 闪点 | 25 °C | ||
| MAK | 不固定[3] | ||
| 相关物质 | |||
| 相关碳氢化合物 | 苯、环丁二烯 | ||
| 相关化学品 | 二聚环戊二烯 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
制备及相关反应

试管中的环戊二烯,置于冰水中。
环戊二烯制备时通常与二聚物混合在一起,并且可以相互转化。工业上,从煤焦油(约10-20g/t)和石脑油(约14kg/t)[4]蒸汽裂解而来[5]。
σ迁移重排
环戊二烯结构中发生的[1,5]-σ氢迁移非常迅速 [6],其单取代衍生物如C5H5E(CH3)3(E= Si, Ge, Sn)的迁移更加迅速,甚至难以分离出其不同的立体异构体,进行相关的反应时也可能因此得到许多异构体混合的产物。
去质子化
环戊二烯有一定酸性(pKa = 16),这可以用去质子化后得到高稳定性的芳香族环戊二烯阴离子Cp−来解释。去质子化反应可以使用氢化钠、金属钠和丁基锂来进行,得到的阴离子盐如环戊二烯基钠、环戊二烯基锂可以用于制备茂基配合物。
用途
环戊二烯可以作为合成茂金属及其衍生物的前体,也可以用于合成橡胶,主要的商业用途是作为共聚单体和有机合成中间体。环戊二烯可以与烯烃发生Diels-Alder反应,得到的衍生物用途广泛,如与乙烯加成得到降冰片烯。环戊二烯卤代后得到的六氯环戊二烯是杀虫剂、农药、阻燃剂、染料的前体。
参见
外部連結
参考文献
- . PubChem Compound. USA: National Center for Biotechnology Information. 16 September 2004 [8 October 2011]. (原始内容存档于2012-02-02).
- Valery I. Faustov, Mikhail P. Egorov, Oleg M. Nefedov and Yuri N. Molin. . Phys. Chem. Chem. Phys. 2000, 2 (19): 4293–4297. doi:10.1039/b005247g.
- Record of CAS RN 542-92-7 in the GESTIS Substance Database from the IFA.
- Hönicke, Dieter; Födisch, Ringo; Claus, Peter; Olson, Michael, , , Weinheim: Wiley-VCH, 2005
- Moffett, Robert Bruce (1962). "Cyclopentadiene and 3-Chlorocyclopentene". Org. Synth.; Coll. Vol. 4: 238.
- Streitwieser, A.; Heathcock, C. H.; Kosower, E. M. 4th. Upper Saddle River, NJ: Prentice Hall. 1998.
- Levandowski, Brian; Houk, Ken. . J. Org. Chem. 2015, 80 (7): 3530–3537. PMID 25741891. doi:10.1021/acs.joc.5b00174.
- Fischer, E. O.; Wawersik, H. [On aromatic complexes of metals: LXXXVIII. On monomeric and dimeric dicyclopentadienylrhodium and dicyclopentadienyliridium, and a new method to represent uncharged metal–aromatic complexes]. J. Organomet. Chem. 1966, 5 (6): 559–567. doi:10.1016/S0022-328X(00)85160-8 (德语).
- Girolami, G. S.; Rauchfuss, T. B.; Angelici, R. J. . Mill Valley, CA: University Science Books. 1999. ISBN 0-935702-48-2.
- Jolly, W. L. . Englewood Cliffs, NJ: Prentice-Hall. 1970. ISBN 0-13-879932-6.
- Green, M. L. H.; Pratt, L.; Wilkinson, G. . Journal of the Chemical Society. 1959: 3753–3767. doi:10.1039/JR9590003753.
- Kolle, U.; Grub, J. . J. Organomet. Chem. 1985, 289 (1): 133–139. doi:10.1016/0022-328X(85)88034-7.
- Paquette, L. A.; Wyvratt, M. J. . J. Am. Chem. Soc. 1974, 96 (14): 4671–4673. doi:10.1021/ja00821a052.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.