生物正交化学
生物正交化学(英語:)指能够在生物系统中发生而且不干扰内源性生物化学过程的化学反应。[1][2][3] 该术语是由美国化学家卡罗琳·贝尔托西于2003年创造的反应。[4]生物正交反应使得对生物体内的生物分子(如糖类、蛋白质[5]和脂类[6]等)的实时研究成为可能。在目前,已发展了大量满足生物正交性的化学偶联策略,如叠氮化合物与环炔烃的1,3-偶极环加成反应(又称无铜点击化学)[7]、硝酮与环炔烃的反应[8]、醛或酮形成肟或腙的反应[9]、四嗪与环状烯烃或环状炔烃的狄尔斯-阿尔德反应[10]、基于异氰化物的点击反应[11],以及四环烷偶联反应[12]。
生物正交化学的使用通常分两个步骤进行。 第一步,用生物正交官能团(化学报告者)修饰细胞底物并将其引入细胞; 底物包括代谢物、酶抑制剂等。化学报告者分子不得显着改变底物的结构,以免影响其生物活性。 第二步,引入含有互补官能团的探针来反应并标记底物。
尽管已经开发出有效的生物正交反应(例如无铜点击化学),但新反应的开发仍在继续产生正交标记方法,以允许在同一生物系统中使用多种标记方法。 卡罗琳·贝尔托西因其对点击化学和生物正交化学的发展而荣获2022年诺贝尔化学奖[13]。
生物正交性的要求
满足生物正交性的化学反应必须满足如下要求:
- 选择性: 反应必须选择性地与目标分子发生反应,没有副反应
- 生物学惰性: 反应物与产物不能干扰内源性生物化学过程。
- 化学惰性:发生偶联的共价键必须足够稳定,不受内源性生物化学反应影响。
- 动力学: 反应必须快速进行,以满足活体实时研究的需要。
- 反应生物兼容性:反應必須是無毒的,並且必須在考慮 pH 值、水環境和溫度的生物條件下發揮作用。 隨著生物正交化學擴展到活體動物模型,藥物動力學越來越受到關注。
- 可操作性: 化学报告分子必须可通过新陈代谢或蛋白质工程等方法引入到生物分子上。通常所引入的官能团要足够小,以免干扰生物分子的生物学功能。
施陶丁格偶联反应
施陶丁格偶联反应是由贝尔托西课题组于2000年基于施陶丁格反应发展而来。[14]
生物正交性
叠氮化物是一种软亲电试剂,因此更倾向于与软亲核试剂膦反应(与多数生物体内亲核体相比)。该反应有很高的选择性,可在水相进行,生成稳定产物。
由于膦不是天然存在于生物体内的化合物,而且也不会还原二硫键,因此避免了副反应的发生。
有机叠氮化物已被证明具有很好的生物兼容性,比如叠氮胸苷早已是FDA批准的药物。叠氮基团由于分子体积小,易于通过新陈代谢引入到生物分子上。
无铜(催化的)点击化学
无铜点击化学不需要使用有毒的铜离子作为催化剂,同时又具有反应快速的优点,因此成为施陶丁格偶联反应的完美替代反应(第一级反应速率提高60倍)。该反应是一种环张力促进的叠氮-炔基环加成反应(SPAAC)。
反应机理
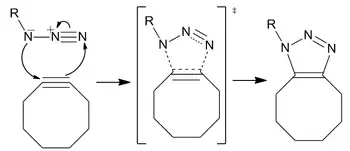
环辛炔的发展
| 环辛炔 | 二级反应速率常数 (M−1s−1) |
|---|---|
| OCT | 0.0024 |
| ALO | 0.0013 |
| MOFO | 0.0043 |
| DIFO | 0.076 |
| DIBO | 0.057 |
| BARAC | 0.96 |
| DIBAC (ADIBO) | 0.31 |
| DIMAC | 0.0030 |
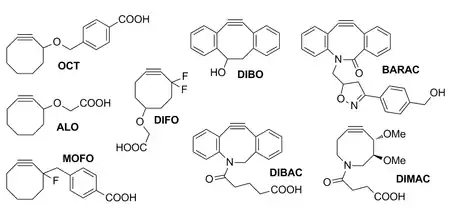
OCT 是首个用于无铜点击化学的环辛炔。环辛炔可在生理条件下与叠氮化物反应,并且没有毒性。但是环辛炔水溶性差,反应速率仅仅略高于施陶丁格反应。
ALO是无芳环的环辛炔。与OCT相比水溶性有所提高,但反应动力学仍然不好。
在环辛炔的炔丙位引入吸电子效应的氟原子,可提高反应性,如单氟化的(MOFO)和双氟化的(DIFO)环辛炔。选氟原子作为吸电子基团的优点还在于合成上的可操作性和生物兼容性的优点。同时,氟取代基不能作为亲电性的麦克尔加成反应受体,避免了与生物体内源性亲核体的副反应。[7]
二苯基环辛炔(DIBO )融合了两个芳环,因而具有很大的环张力。虽然理论计算表明单芳环取代物可提供最优的反应空间位阻与环张力的平衡[18] ,但是单芳环取代物不够稳定,难以实际应用。
其他生物正交反应
降冰片烯环加成反应
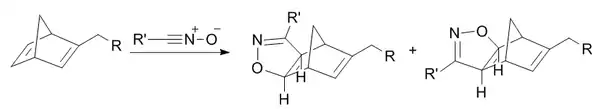
氧杂降冰片二烯环加成反应

四嗪偶联反应
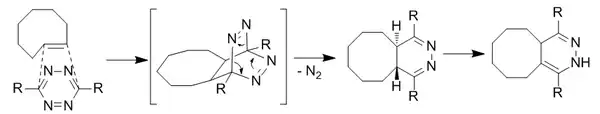
[4+1]环加成反应
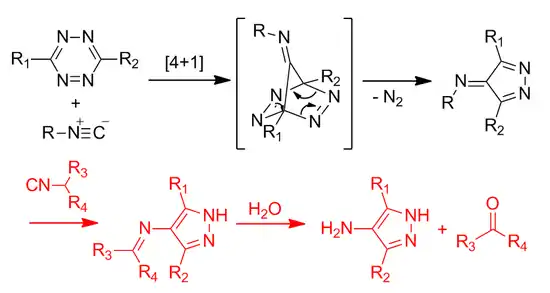
四唑光点击化学
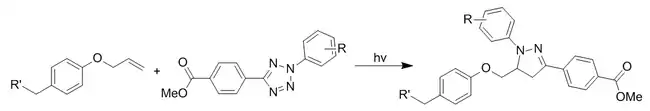
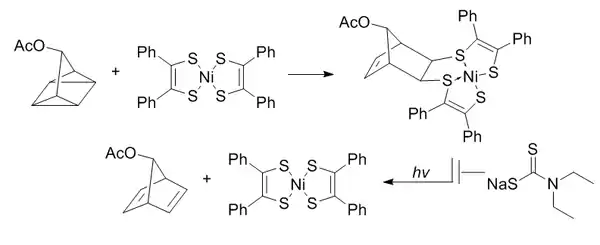
四环庚烷偶联反应
参考文献
- Sletten, Ellen M.; Bertozzi, Carolyn R. . Angewandte Chemie International Edition. 2009, 48 (38): 6974–98. PMC 2864149
 . PMID 19714693. doi:10.1002/anie.200900942.
. PMID 19714693. doi:10.1002/anie.200900942. - Prescher, Jennifer A.; Dube, Danielle H.; Bertozzi, Carolyn R. . Nature. 2004, 430 (7002): 873–7. PMID 15318217. doi:10.1038/nature02791.
- Prescher, Jennifer A; Bertozzi, Carolyn R. . Nature Chemical Biology. 2005, 1 (1): 13–21. PMID 16407987. doi:10.1038/nchembio0605-13.
- Sletten, Ellen M.; Bertozzi, Carolyn R. . Accounts of Chemical Research. 2011, 44 (9): 110815072703056. doi:10.1021/ar200148z.
- Plass, Tilman; Milles, Sigrid; Koehler, Christine; Schultz, Carsten; Lemke, Edward A. . Angewandte Chemie International Edition. 2011, 50 (17): 3878. doi:10.1002/anie.201008178.
- Neef, Anne B.; Schultz, Carsten. . Angewandte Chemie International Edition. 2009, 48 (8): 1498–500. PMID 19145623. doi:10.1002/anie.200805507.
- Baskin, J. M.; Prescher, J. A.; Laughlin, S. T.; Agard, N. J.; Chang, P. V.; Miller, I. A.; Lo, A.; Codelli, J. A.; Bertozzi, C. R. . Proceedings of the National Academy of Sciences. 2007, 104 (43): 16793–7. PMC 2040404
 . PMID 17942682. doi:10.1073/pnas.0707090104.
. PMID 17942682. doi:10.1073/pnas.0707090104. - Ning, Xinghai; Temming, Rinske P.; Dommerholt, Jan; Guo, Jun; Blanco-Ania, Daniel; Debets, Marjoke F.; Wolfert, Margreet A.; Boons, Geert-Jan; Van Delft, Floris L. . Angewandte Chemie International Edition. 2010, 49 (17): 3065. doi:10.1002/anie.201000408.
- Yarema, K. J.; Mahal, LK; Bruehl, RE; Rodriguez, EC; Bertozzi, CR. . Journal of Biological Chemistry. 1998, 273 (47): 31168–79. PMID 9813021. doi:10.1074/jbc.273.47.31168.
- Blackman, Melissa L.; Royzen, Maksim; Fox, Joseph M. . Journal of the American Chemical Society. 2008, 130 (41): 13518–9. PMC 2653060
 . PMID 18798613. doi:10.1021/ja8053805.
. PMID 18798613. doi:10.1021/ja8053805. - Stöckmann, Henning; Neves, André A.; Stairs, Shaun; Brindle, Kevin M.; Leeper, Finian J. . Organic & Biomolecular Chemistry. 2011, 9 (21): 7303. doi:10.1039/C1OB06424J.
- Sletten, Ellen M.; Bertozzi, Carolyn R. . Journal of the American Chemical Society. 2011, 133 (44): 17570–3. PMC 3206493
 . PMID 21962173. doi:10.1021/ja2072934.
. PMID 21962173. doi:10.1021/ja2072934. - . The Nobel Prize. [6 October 2022]. (原始内容存档于2024-02-25).
- Saxon, E.; Bertozzi, CR. . Science. 2000, 287 (5460): 2007–10. PMID 10720325. doi:10.1126/science.287.5460.2007.
- Pamela, Chang.; Prescher, Jennifer A.; Hangauer, Matthew J.; Bertozzi, Carolyn R. . J Am Chem Soc. 2008,. July 11; 129(27) (27): 8400–8401. PMC 2535820
 . PMID 17579403. doi:10.1021/ja070238o.
. PMID 17579403. doi:10.1021/ja070238o. - Huisgen, Rolf. . The Journal of Organic Chemistry. 1976, 41 (3): 403. doi:10.1021/jo00865a001.
- Schoenebeck, Franziska; Ess, Daniel H.; Jones, Gavin O.; Houk, K. N. . Journal of the American Chemical Society. 2009, 131 (23): 8121–33. PMID 19459632. doi:10.1021/ja9003624.
- Chenoweth, Kimberly; Chenoweth, David; Goddard Iii, William A. . Organic & Biomolecular Chemistry. 2009, 7 (24): 5255. doi:10.1039/B911482C.