病毒概論
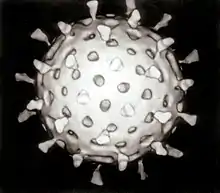
病毒是一種依靠宿主的細胞来繁殖的類生物體。在感染宿主細胞之後,病毒就會迫使宿主細胞以很快的速度製造、裝配出數千份與它(病毒)相同的拷貝。不像大多數生物體,病毒沒有會分裂的細胞,新的病毒是在宿主細胞內生產、組裝的。不過,與構造更簡單的傳染性病原體朊病毒不同,病毒含有能使得它們發生變異和進化的核酸。目前,人們已經發現了超過5000種的病毒[1]。
| ||||||
病毒的起源至今不明。有些病毒可能是由質粒,即一種可在細胞間移動的環狀DNA進化而來。同時,也有些病毒可能是由細菌進化而來。病毒由兩或三種結構組成。其中,所有病毒都有的兩種結構是化學本質爲DNA或RNA的核酸與保護基因的蛋白質外殼。其中,核酸爲攜帶遺傳訊息的長鏈狀分子。部分病毒還有一個由脂肪構成的包裹着病毒體的病毒包膜。病毒包膜可以在病毒處於宿主細胞胞外時爲它們提供保護。病毒的形狀變化多樣,既有螺旋形、二十面體形的病毒,也有擁有更為複雜的幾何結構的噬菌體。病毒的大小在20納米到300納米之間,把30,000到500,000個病毒一個個緊靠着排列起來才能達到1厘米的長度。
病毒有多種傳播方式。很多病毒會攻擊特定的生物體或生物組織,每一種病毒也有特定的傳播方式。植物病毒通常通過昆蟲或其它生物體在植物间傳播,這種幫助病毒擴散的生物體稱爲「病媒」。一些動物病毒,包括人會染上的病毒,會通過被它感染的體液傳播。而像流感病毒這樣的病毒則是藉由人打噴嚏或咳嗽時產生的飛沫液滴在空氣中傳播的。而以諾如病毒爲代表的一類病毒則是通過糞口途徑傳播,被污染的手、食物、水等都可以傳播這類病毒。輪狀病毒則通常是通過與被感染的兒童的直接接觸傳播。艾滋病病毒可通過性交傳播,因爲進行性交時雙方會產生體液的轉移。另外,登革熱病毒可以通過吸血昆蟲傳播。
病毒感染会使人、动物甚至植物生病,不过宿主的免疫系统通常能清除病毒,并产生终身的免疫力。抗生素对病毒无效,但人们已开发出抗病毒药以治疗威胁生命的病毒感染。疫苗也能使宿主产生终身免疫以预防某些病毒感染。
发现
1884年法国微生物学家查理斯·尚柏朗发明了一种过滤器(现称作尚柏朗过滤器或尚柏朗-巴斯德过滤器),它的孔径比细菌还小。他想用這種過濾器過濾含有細菌的溶液,以完全去除里面的細菌[2]。1890年代初,俄国生物学家德米特里·伊凡诺夫斯基在研究现在我们所说的烟草花叶病毒時就用到了這種過濾器。當時,他從染病的煙草植株那裏剪取了一些煙草葉並將它們碾碎。隨後,他發現,這些碎葉的提取液在通過尚柏朗過濾器後仍然具有感染性。
与此同时,其他几位科学家证实,这些后来被称为病毒的媒介虽然与细菌不同,但仍可致病。它们的大小大概是细菌的百分之一。1899年荷兰微生物学家马丁努斯·拜耶林克观察到这种媒介只在分裂細胞中繁殖。他不能确定这种媒介到底是什么,所以就称之为“contagium vivum fluidum”(意爲“可溶性活菌”)。[3] 20世纪初英国细菌学家弗雷德里克·图尔特发现了能感染细菌的病毒[4]。法裔加拿大籍微生物学家费利克斯·迪海莱亦在該階段發現,如果把一種病毒加到培養有細菌的琼脂培養基上,那麼這個培養基中的细菌就会成片死亡。通過數出出現細菌大規模死亡的區域數,他就能算出培養基中的病毒数量。[5]
藉助德国工程师恩斯特·鲁斯卡和马克斯·克诺尔於1931年發明的电子显微镜,人们第一次看到了病毒的影像[6]。 1935年美国生物化学家兼病毒学家温德尔·梅雷迪思·斯坦利通過對烟草花叶病毒的研究,確認了其主要成分爲蛋白質[7]。 不久之后,这种病毒就被分离成蛋白质和RNA两部分。[8] 起初,科学家面临的问题是不知道如何不依靠活动物来培养病毒。1931年美国病理学家欧内斯特·古德帕斯彻在雞胚中培养了包括流感病毒在內的几种病毒,成功在這個問題上取得了突破。[9]然而,有些病毒卻无法用雞胚培养。不过,在1949年约翰·富兰克林·恩德斯、托马斯·哈克尔·韦勒和弗雷德里克·查普曼·罗宾斯利用培養有活的动物细胞的培養基成功培養出了脊髓灰质炎病毒之後,這一難題也就迎刃而解。[10] 现已发现超过5000种病毒。[11]
起源
哪里有生命,哪里就有病毒与之共存。活细胞开始进化之初就可能有病毒存在。因为病毒不形成化石,所以它的起源仍然不明。分子生物学方法是推究病毒起源的最有效方法。不过这些方法需要取得古老病毒的DNA或RNA,但現在的實驗室卻鮮有儲存超過90年的病毒[12][13]。 分子生物学方法只能追溯在二十世纪演化出的病毒的祖先。[14]
- 退化假说認為,病毒可能曾是寄生在大细胞裡的小细胞。久而久之,這些小細胞中寄生用不到的基因就丟失了。退化假說的證據之一是細菌域下的立克次体和衣原体雖然是活細胞,卻像病毒一样只能在宿主细胞内繁殖這一事實。這兩種細菌對寄生的依賴性可能就是由它們失去了能使自己在细胞外独立生存的基因造成[17]。
- 共同进化学说認為,病毒是從一些复杂的蛋白质和DNA分子演化而來的。它們與細胞幾乎同時於地球上出現,并在接下来的数百万年中依赖于细胞生物而生存。[19]
然而,这些假说各有各的问题:退化假说无法解释为何连最小的依賴寄生生存的細胞生物都一点也不像病毒,而细胞起源假说則不能解釋病毒爲何呈現現在的结构。共同进化学说,或称病毒先出現学说,則与病毒的定义矛盾,因为病毒必须依赖宿主细胞存活[19]。 但是病毒肇源久远,可追溯到生命进化分出三域以前。[20]这项发现使现在的病毒学家不得不對这三种经典假说進行反思和重新審視。[20]
結構
Virus_stucture_simple.png.webp)
病毒粒子,亦稱爲「病毒體」(viron),由化學本質爲DNA或RNA的基因和包裹着基因的蛋白質外殼構成。[21]这个外殼叫做「衣殼」(capsid),由許多更小的相同蛋白質分子(即殼粒)組成。由殼粒堆砌而成的衣殼可以呈二十面體,螺旋形,也可以呈現出更加複雜的形狀。另外,病毒還擁有一個稱爲「核殼體」(nucleocapsid)的結構。它位於衣殼內部,包裹着病毒的核酸,化學本質爲蛋白質。另外,一些病毒在衣殼外還擁有脂質(脂肪)構成的包膜。
大小
病毒是最小的感染源之一,光学显微镜觀察不到大部分的病毒,因此病毒屬於亞顯微結構。大部分病毒只能用电子显微镜观察。病毒的大小从20到300纳米不等,把30,000到750,000個病毒一個個緊靠着排列起來才能達到1厘米的長度。[21] 相比之下,细菌的直径通常在1微米(合1000纳米)左右,高等生物的细胞直径为几十微米。有些病毒比较大,如分別於2003年和2013年发现的能感染变形虫的巨大病毒和潘多拉病毒,直径可达1 微米,大約比流感病毒大一千倍。这些「庞大」的病毒的发现令科學家們相當驚訝。[22]
基因
基因的化學本質通常爲DNA(脱氧核糖核酸),不過也有不少病毒的基因的化學本質爲RNA(核糖核酸)。基因编码了生物体所含的生物信息。多数生物的遗传物质是DNA,但RNA病毒的遗传物质是RNA。病毒的DNA或RNA由单链或双螺旋组成。[23]
病毒繁殖非常迅速,因为它只有几个基因。 例如,流感病毒只有8个基因,轮状病毒只有11个。相比之下,人类有2万到2万5千个基因。这些基因编码了构成病毒颗粒的结构蛋白和只在宿主细胞中合成的非结构蛋白。[24][25]
像所有细胞一样,很多病毒会产生用以复制DNA和RNA的蛋白质,分别称为DNA聚合酶和RNA複製酶。病毒的這些酶合成DNA和RNA的效率通常比宿主细胞的這些酶更高。[26] 不过RNA聚合酶经常出错,这就是RNA病毒常会突变成新的類型的原因之一。[27]
有些RNA病毒的基因并不是一个连续的RNA分子,而是分开的几段,例如流感病毒的基因由八段RNA组成。当两种不同的流感病毒感染同一细胞时,这些基因可能会相互混合,並基因重配成新類型的病毒。[28]
蛋白質合成
蛋白質對生物體來說不可或缺。在DNA中遺傳信息指導下,細胞利用一個個氨基酸作爲結構單元合成蛋白質。蛋白質具有專一性,通常只具有一種功能。所以,一個細胞如果想要進行一種新的生命活動的話,它就必須合成一種新的蛋白質。病毒會迫使宿主細胞合成宿主不需要但病毒在複製過程中要用到的蛋白質。蛋白質合成分爲兩步:轉錄和轉譯。
轉錄是把DNA上的遗传信息复制到信使RNA(mRNA)上的过程。在完成了轉錄之後,信使RNA會通過核孔穿過核膜(多數信使RNA在離開細胞核之前還會經過進一步的加工和修飾),與細胞質中的核糖體結合,並用它所攜帶的遺傳信息合成蛋白質。其中核糖體讀取信使RNA攜帶的遺傳信息,並合成蛋白質的過程稱爲「轉譯」。轉譯使mRNA上的遺傳信息以胺基酸排序的方式流入合成的多肽鏈中[29]。
有些RNA病毒的核酸可不經進一步加工直接發揮mRNA的作用,这些病毒因此称为正义RNA病毒。[30]另一些RNA病毒的RNA与mRNA互补,这些病毒需要宿主细胞或它们自己的酶合成mRNA,它们称为反义RNA病毒。DNA病毒合成mRNA的方式和细胞相似。逆转录病毒的行爲較爲特殊:它們攜帶RNA,但它們在感染宿主细胞後會利用逆转录酶把它們的RNA逆轉錄爲一段DNA。隨後,這段DNA會被整合到宿主細胞的DNA中。之後,宿主細胞會「渾然無知」地將這段DNA上攜帶的遺傳信息轉錄到信使RNA中,就像轉錄其他的DNA片段一樣[31]。
生命週期
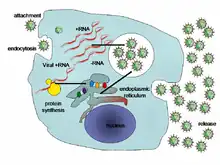
一個病毒在感染细胞后,會迫使宿主細胞「製造」出數以千計的子代病毒。病毒會通過讓宿主細胞複製它(病毒)的DNA或者RNA,合成它(病毒)的蛋白質。這些核酸和蛋白質之後會組合成新的病毒[32]。
病毒在活细胞中的生命周期分爲六个基本阶段,它们互有交集:[33]
- 附着:病毒首先与宿主细胞表面的特定分子结合。因爲這種結合作用具特异性,病毒只能感染少数几种细胞。例如,艾滋病毒(HIV)只能感染人类T细胞,因为其表面蛋白gp120只能与T细胞表面的CD4等分子结合。植物病毒只能感染植物而不能感染动物。这种附着机制經過不断的进化,使病毒更加「鍾愛」那些能够讓它們完成複製的細胞。
- 進入細胞:病毒附着到宿主细胞表面之后,通过胞吞或膜融合进入细胞。
- 核酸的脫出:病毒自己的或宿主细胞中的酶將病毒的衣殼降解破坏,病毒的核酸释放。
- 合成:宿主细胞的蛋白质合成系统以病毒的信使RNA爲模板合成病毒蛋白,同时细胞也合成病毒的DNA或RNA。
- 组装:上一步中合成的病毒的蛋白质和核酸组装成数百个新的病毒颗粒。
- 释放:在完成了上述步驟之後,新病毒會从宿主细胞中脱离释放。多数病毒在該過程中会使宿主细胞溶解破裂,另一些病毒(如HIV)则通过出芽等较温和的方式从细胞中释放。
对宿主细胞的影响
病毒对宿主细胞的结构和生化成分会产生广泛的影响,[34] 这些影响称为“细胞病变效应”。[35] 多数病毒感染最终会导致宿主细胞死亡。死亡的方式有裂解、细胞膜病变和凋亡(即“自杀”)等。[36]通常宿主细胞死亡是因为病毒合成的蛋白质终止了它們的正常生命活动,这些蛋白质不一定是组成病毒颗粒的蛋白质。[37]
有些病毒不会使宿主细胞发生明显变化。这些病毒潜伏在细胞里,活動並不活躍。在該階段,细胞通常功能正常,且基本不會出現感染迹象。[38]病毒会潜伏数月乃至数年,这会引起长期感染,皰疹病毒就往往表現如此。[39][40]
有些病毒,如人类疱疹病毒第四型(EB病毒)常会导致细胞增生,但卻不會造成惡性腫瘤[41]。不过,已證實人类乳头瘤病毒等病毒確有致癌作用。[42] 当病毒將宿主细胞的DNA破壞到該細胞无法自我修复时,這個细胞就会凋亡。細胞發生凋亡時,它会彻底破坏受损的DNA。有些病毒拥有限制细胞凋亡的机制,使宿主细胞在完成子代病毒的合成之前不會死亡。HIV(愛滋病病毒)就有這樣的機制。[36]
病毒引起的疾病
由病毒引起的普通人类疾病有普通感冒、流感、水痘和唇疮,较为严重的有埃博拉和艾滋病。很多病毒不致病或几乎不致病,称为“良性病毒”。對人類有害的病毒具有“病毒性”。不同细胞被不同病毒感染后引起的病症也不同。有些病毒会导致慢性甚至终身性的病症,宿主染上這類病毒之後,其防禦系統也無法將病毒清除,病毒會一直在其体内繁殖[43]。被乙肝病毒或丙肝病毒感染的人就常常如此。受病毒慢性感染的人称为病毒携带者。他们是病毒主要的藏身處之一。如果某地某種病毒的攜帶者佔總人口比率高的話,我們就說这种病毒成為該地區的地方性流行病。[44]
病毒在宿主间的传播方式有很多,但每种病毒只会利用其中的一两种。很多植物病毒通过称为病媒的载体传播。有些感染动物(包括人类)的病毒也由病媒(通常是吸血昆虫)传播,不过直接传播更为常见。有些病毒(如诺如病毒和轮状病毒)通过食物、水、手和公用物品传播,人在與其他受感染者密切接触之後也可能會染上這類病毒。[45]還有一些病毒(如流感病毒)通过空气传播。[46]艾滋病、乙肝、丙肝等病毒則通常通过不安全的性接触[47]或受污染的注射器针头传播。[48]了解各种病毒的传播途徑对预防病毒感染和流行至關重要。[49]
植物疾病

植物病毒有很多种,但通常它们只会影响作物产量。對植物病毒進行防控也不經濟。植物病毒常由病媒生物在植物间传播。这种病媒通常是昆虫,但一些真菌、線虫門動物和单细胞生物亦可能成爲病媒。有時候,對植物病毒進行防控也比較經濟(比如作物是多年生的產水果植株的時候),不過防控的重點通常是撲殺病媒以及清除相關植物病毒的其他宿主(比如雜草)[50]。 植物病毒只能在植物细胞中繁殖,因而对人类和动物无害。[51]
噬菌体
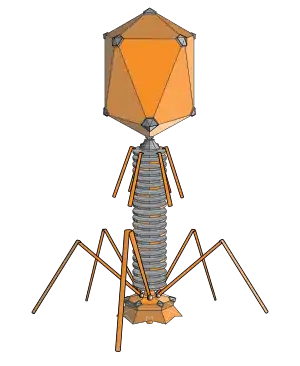
噬菌体是以细菌和古菌作爲宿主的病毒。国际病毒分类委员会將噬菌體分成11科28属。[52]噬菌体对海洋生态学来说很重要,因为受感染的细菌破裂后,含碳化合物會释放回环境中,刺激新生物的生长。噬菌体在科学研究中很有用,因为它们对人类无害,研究起来很方便。但在食品、制药等行业,噬菌体可能會帶來一些麻烦,因为发酵需要健康的细菌。有些细菌感染用抗生素难以对付,因而用噬菌体治疗細菌感染已成爲一個越來越熱門的課題。[53]
动物的先天免疫
包括人类在内的动物先天就有很多抵御病毒的方式。其中,一些方式是非特異性的。也就是說,它們能對所有的病毒起防禦作用。先天免疫不会在多次接触病毒后增强,對病毒感染也没有“记忆力”。动物的皮肤,尤其是由死细胞構成的皮膚表層,能將多種病毒拒之門外。胃酸亦能消灭很多被吞入消化道的病毒。即使病毒突破这些屏障,进入了宿主体内,也还有其他的先天免疫途徑能阻止病毒在体内扩散。比如,宿主会产生一种叫干扰素的激素來杀死被病毒感染的细胞和與之相邻的细胞以阻止病毒繁殖。细胞内部也有能破坏病毒RNA的酶。該過程被稱爲RNA干擾。此外,有些血细胞能吞噬受病毒感染的细胞並將之「摧毀」。[54]
动物的后天免疫
对病毒的特异性免疫是逐步发展出来的,其中叫做淋巴细胞的白细胞起了重要的作用。淋巴细胞对病毒感染有“记忆力”,并且能合成许多特别的分子,称为抗体。这些抗体能附着在病毒上,阻止它感染细胞。抗体有很强的针对性,只能攻击一种病毒。宿主能产生多种抗体,特别是刚刚受到感染时。感染消退后,宿主仍能继续产生抗体,体内留存的抗体通常能使宿主对病毒拥有终身免疫力。[55]
植物的抵抗力
植物对病毒拥有复杂而有效的防御机制,其中最有效的是所谓的抗性(R)基因。每个R基因会使受感染细胞周围的局部细胞死亡,产生肉眼可见的大斑块,从而使植物对特定病毒有抵抗力。这样病毒感染就无法传播了[56]。RNA干扰也是植物抵御病毒感染的有效方式[57]。植物受感染时也会产生天然抗感染物质摧毁病毒,如水杨酸、一氧化氮和活性氧等[58]。
细菌对噬菌体的抵抗力
细菌能合成一種叫做限制性核酸內切酶的酶作爲它們防禦噬菌體的主要手段。這種酶能破壞外來的DNA。噬菌體注入細菌體內的DNA可被這種酶破壞。
接种疫苗

预防病毒性疾病的方法之一是接种疫苗。疫苗能在不致病的情況下模拟自然感染,並激發相應的免疫應答。通過普及疫苗接种,人類已消灭了天花。此外,脊髓灰质炎、麻疹、风疹和腮腺炎的发病率和死亡率也顯著降低[59]。超过十三种由病毒引起的人類疾病已有相應的疫苗,[60]能预防其他動物感染病毒的疫苗則更多[61]。疫苗可用生活病毒或已殺滅的病毒制作。[62]活病毒疫苗中含有经过减毒的病毒,但给免疫缺陷的人群接种這類病毒很危险。这些人接种减毒疫苗会染上相應的疾病[63]。通過生物技术和基因工程技术能制造“特制”的疫苗,它只含有病毒的蛋白质衣壳。乙肝疫苗就属于这种類型的疫苗。[64] 这些疫苗更安全,因为從理論上講它們決不可能致病[65]。
抗病毒药
近二十年来,艾滋病的流行使抗病毒药发展迅速。抗病毒药的有效成分通常是核苷类似物这样的核苷类似物有抗疱疹病毒感染的阿昔洛韦和抗HIV和乙肝病毒的拉米夫定。阿昔洛韦是最早的抗病毒药之一,也是最常使用的抗病毒药之一(2008年數據)[66]。
其他的抗病毒药针对病毒生命周期的其他阶段。HIV需要HIV-1蛋白酶才具有傳染性。有一类称为蛋白酶抑制剂的药物,能与这种酶结合,使它失效。[67]
丙肝由RNA病毒引起。80%的感染者的丙肝都会变成慢性的,若不接受治療,终身都有傳染性。联合使用利巴韦林和干扰素能有效治疗丙肝。[68]与此类似,使用拉米夫定等抗病毒药對慢性乙肝患者進行治療的方法也在开发中。[69]。在上述兩種情形中,抗病毒药能阻止病毒複製,而干扰素则會杀灭剩下的受感染细胞。
HIV病毒感染通常用几种抗病毒药联合治疗,該療法中的每一種藥物都會在病毒生命周期的不同阶段起效。其中,有藥物能阻止病毒附着在细胞上,有藥物爲核苷類似物,还有的藥物能抑制病毒繁殖所必须的酶。[67]
病毒在生態學中的角色
在水生生物生活的環境中,病毒是數量最多的生物體[70]——光是一茶匙的海水中就含有100萬個病毒[71]。它們在海洋生態系統和淡水生態系統的調節過程中扮演着重要角色[72]。水中的病毒大都是對動植物無害的噬菌體。它們能夠感染并殺滅水生生物群落中的細菌——這一過程對海洋生態系統的碳循環過程至關重要。因噬菌體的感染而裂解的細菌會释放出有機分子。這些有機分子能促進細菌的新生以及藻類的生長[73]。
微生物構成了海洋中的90%的生物質。据估计每天病毒就能殺滅约20%的生物質,海洋中的病毒数量是细菌和古菌數目總和的十五倍。病毒能是使藻華快速消滅的主力軍。藻華是一類能在短時間內導致水生生物大量死亡的藻類集群[74][75]海洋中,离海岸越远、深度越深的區域,病毒宿主數目和病毒數目越少。[76]。
在海洋生態系統中,病毒扮演着重要角色。它们能增强海洋生物的呼吸作用,每年可使大气中的二氧化碳含量減少約110億噸[76]。
海洋哺乳动物也会受病毒感染。1988年和2002年,海豹瘟热病毒在歐洲殺死了數以千計的海豹[77]。杯状病毒、疱疹病毒、腺病毒和细小病毒等亦在海洋哺乳動物中流行。[76]
参考文献
引用
- Leppard, Keith; Nigel Dimmock; Easton, Andrew. . Blackwell Publishing Limited. 2007: 4. ISBN 1-4051-3645-6.
- Shors pp. 76–77
- Topley and Wilson p. 3
- Shors p. 589
- D'herelle, F. . Research in microbiology. 2007, 158 (7): 553–4. PMID 17855060. doi:10.1016/j.resmic.2007.07.005.
- From Nobel Lectures, Physics 1981–1990, (1993) Editor-in-Charge Tore Frängsmyr, Editor Gösta Ekspång, World Scientific Publishing Co., Singapore
- Stanley, W.M.; Loring, H.S. . Science. 1936, 83 (2143): 85. Bibcode:1936Sci....83...85S. PMID 17756690. doi:10.1126/science.83.2143.85.
- Stanley, W.M.; Lauffer, M.A. . Science. 1939, 89 (2311): 345–347. Bibcode:1939Sci....89..345S. PMID 17788438. doi:10.1126/science.89.2311.345.
- Goodpasture, E.W.; Woodruff, A.M.; Buddingh, G.J. . Science. 1931, 74 (1919): 371–372. Bibcode:1931Sci....74..371G. PMID 17810781. doi:10.1126/science.74.1919.371.
- Rosen, F.S. . New England Journal of Medicine. 2004, 351 (15): 1481–83. PMID 15470207. doi:10.1056/NEJMp048202.
- Dimmock, N.J; Easton, Andrew J; Leppard, Keith. sixth edition. Blackwell Publishing. 2007: 49. ISBN 1-4051-3645-6.
- Shors. p. 16
- Topley and Wilson pp. 18–19
- Liu, Y; Nickle, DC; Shriner, D; Jensen, MA; Learn Jr, GH; Mittler, JE; Mullins, JI. . Virology. 2004, 329 (1): 101–8. PMID 15476878. doi:10.1016/j.virol.2004.08.014.
- Shors pp. 14–16
- Topley and Wilson pp.11–21
- Topley and Wilson p. 11
- Topley and Wilson pp. 11–12
- Wessner D. R. . Nature Education. 2010, 3 (9): 37.
- Mahy WJ & Van Regenmortel MHV (eds). Desk Encyclopedia of General Virology. Oxford: Academic Press; 2009. ISBN 0-12-375146-2. p. 28.
- Topley and Wilson pp. 33–55
- Zimmer, Carl. . New York Times. 18 July 2013 [20 December 2014]. (原始内容存档于2015-09-05).
- Shors pp. 54–61
- Shors p. 73
- International Human, Genome Sequencing Consortium. . Nature. 2004, 431 (7011): 931–945. Bibcode:2004Natur.431..931H. PMID 15496913. doi:10.1038/nature03001.
- Shors pp. 32–34
- Shors p. 510
- Shors p. 327
- 吳相鈺等. . 高等教育出版社. : P259–P261. ISBN 7-04-014584-7.
- Topley and Wilson pp. 75–82
- Shors pp. 248–250
- Shors pp. 11–12
- Shors pp. 47–67
- Collier pp. 115–146
- Collier p. 115
- Roulston A, Marcellus RC, Branton PE; Marcellus; Branton. . Annu. Rev. Microbiol. 1999, 53 (1): 577–628 [2014-12-20]. PMID 10547702. doi:10.1146/annurev.micro.53.1.577.
- Alwine JC. . Curr. Top. Microbiol. Immunol. Current Topics in Microbiology and Immunology. 2008, 325: 263–79. ISBN 978-3-540-77348-1. PMID 18637511. doi:10.1007/978-3-540-77349-8_15.
- Sinclair J. . J. Clin. Virol. March 2008, 41 (3): 180–5 [2014-12-20]. PMID 18164651. doi:10.1016/j.jcv.2007.11.014. (原始内容存档于2017-11-02).
- Jordan MC, Jordan GW, Stevens JG, Miller G; Jordan; Stevens; Miller. . Ann. Intern. Med. June 1984, 100 (6): 866–80. PMID 6326635. doi:10.7326/0003-4819-100-6-866.
- Sissons JG, Bain M, Wills MR; Bain; Wills. . J. Infect. February 2002, 44 (2): 73–7 [2014-12-20]. PMID 12076064. doi:10.1053/jinf.2001.0948. (原始内容存档于2017-11-02).
- Barozzi P, Potenza L, Riva G, Vallerini D, Quadrelli C, Bosco R, Forghieri F, Torelli G, Luppi M; Potenza; Riva; Vallerini; Quadrelli; Bosco; Forghieri; Torelli; Luppi. . Autoimmun Rev. December 2007, 7 (2): 132–6 [2014-12-20]. PMID 18035323. doi:10.1016/j.autrev.2007.02.018. (原始内容存档于2017-11-02).
- Subramanya D, Grivas PD; Grivas. . Postgrad Med. November 2008, 120 (4): 7–13. PMID 19020360. doi:10.3810/pgm.2008.11.1928.
- Shors p. 483
- Topley and Wilson p. 766
- Shors p. 118
- Shors p.117
- Shors p. 119
- Shors p.123
- Shors pp. 16–19
- Shors p. 584
- Shors pp. 562–587
- Fauquet, CM. . Boston: Academic Press. 2009: 82. ISBN 0-12-375146-2.
- Shors pp. 588–604
- Shors pp. 146–158
- Shors pp.158–168
- Dinesh-Kumar, S.P.; Tham, Hong; -1#Wai-, Baker. . PNAS. 2000, 97 (26): 14789–94. Bibcode:2000PNAS...9714789D. PMC 18997
 . PMID 11121079. doi:10.1073/pnas.97.26.14789.
. PMID 11121079. doi:10.1073/pnas.97.26.14789. - Shors pp. 573–576; Shou-Wei Ding, Olivier Voinnet. . Cell: 413–426. [2018-04-02]. doi:10.1016/j.cell.2007.07.039. (原始内容存档于2017-11-03). PMID 17693253
- Soosaar, J.L.; Burch-Smith, T.M.; Dinesh-Kumar, S.P. . Nature Reviews Microbiology. 2005, 3 (10): 789–98. PMID 16132037. doi:10.1038/nrmicro1239.
- Shors pp. 171–185
- Shors p. 183
- Pastoret, P.P.; Schudel, A.A.; Lombard, M. . Rev. Off. Int. Epizoot. 2007, 26 (2): 489–94, 495–501, 503–9. PMID 17892169.
- Shors p. 172
- Thomssen, R. . Monographs in allergy. 1975, 9: 155–76. PMID 1090805.
- Shors p. 174
- Shors p. 180
- Shors p. 426
- Shors p. 463
- Witthoft, T.; Moller, B.; Wiedmann, K.H.; Mauss, S.; Link, R.; Lohmeyer, J.; Lafrenz, M.; Gelbmann, C.M.; Huppe, D.; et al. . J Viral Hepat. 2007, 14 (11): 788–796. PMC 2156112
 . PMID 17927615. doi:10.1111/j.1365-2893.2007.00871.x.
. PMID 17927615. doi:10.1111/j.1365-2893.2007.00871.x. - Paul N, Han SH; Han. . Current Hepatitis Reports. June 2011, 10 (2): 98–105. PMC 3085106
 . PMID 21654909. doi:10.1007/s11901-011-0095-1.
. PMID 21654909. doi:10.1007/s11901-011-0095-1. - Koonin EV, Senkevich TG, Dolja VV; Senkevich; Dolja. . Biology Direct. 2006, 1 (1): 29. PMC 1594570
 . PMID 16984643. doi:10.1186/1745-6150-1-29.
. PMID 16984643. doi:10.1186/1745-6150-1-29. - Shors p. 4
- Shors p. 5
- Shors p. 593
- . www.cdc.gov. [23 August 2009]. (原始内容存档于2009-08-27).
- Suttle CA. . Nature. September 2005, 437 (7057): 356–61. Bibcode:2005Natur.437..356S. PMID 16163346. doi:10.1038/nature04160.
- Suttle CA. . Nature Reviews Microbiology. October 2007, 5 (10): 801–12. PMID 17853907. doi:10.1038/nrmicro1750.
- Hall, A; Jepson, P; Goodman, S; Harkonen, T. . Biological Conservation. 2006, 131 (2): 221–229. doi:10.1016/j.biocon.2006.04.008.
来源
- 书籍
- Collier, Leslie; Balows, Albert; Sussman Max (1998) Topley and Wilson's Microbiology and Microbial Infections ninth edition, Volume 1, Virology, volume editors: Mahy, Brian and Collier, Leslie. Arnold. ISBN 0-340-66316-2
- Shors, Teri (2008). Understanding Viruses. Jones and Bartlett Publishers. ISBN 0-7637-2932-9
外部链接
| 關於病毒 的圖書館資源 |