硝普钠
硝普钠(英語:)簡稱SNP,又稱亚硝基铁氰化钠(Sodium Nitroferricyanide),為強效血管擴張劑,可以用來降低血壓[1]。可於高血壓急症時用作降血壓藥,並可用於某些心臟衰竭的治療,也可以用於減少手術中流血[1],本品經靜脈注射給藥[1],藥效通常馬上作用,並可維持約10分鐘[1]。
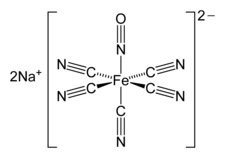 | |
 硝普钠结构式及實物 | |
| 臨床資料 | |
|---|---|
| 商品名 | Nipride, Nitropress, others |
| 其他名稱 | SNP |
| AHFS/Drugs.com | Monograph |
| 核准狀況 |
|
| 懷孕分級 |
|
| 给药途径 | 注射 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 藥物動力學數據 | |
| 生物利用度 | 100%(注射) |
| 药物代谢 | 血红蛋白转化为氰化血红蛋白和氰化物离子 |
| 藥效起始時間 | 幾乎立刻[1] |
| 生物半衰期 | <2分鐘(以硫氰酸盐代谢物形式維持3天) |
| 作用時間 | 1至10分鐘[1] |
| 排泄途徑 | 腎(100%,以硫氰酸鹽形式代謝)[2] |
| 识别 | |
| |
| CAS号 | 13755-38-9 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.119.126 |
| 化学 | |
| 化学式 | C5FeN6Na2O |
| 摩尔质量 | 261.918 |
| 3D模型(JSmol) | |
| 密度 | 1.72 g/cm3 |
| 水溶性 | 100 mg/mL (20 °C) |
| |
| |
常見的副作用包括低血壓及氰化物中毒[1],而其他較嚴重的副作用則有正鐵血紅蛋白血症等[1]。一般而言妊娠期間不建議使用[3]。此外也不建議連續以高劑量施打超過10分鐘以上[4]
硝普鈉早在1850年就已被合成出來,並於1928年發現可用於醫治病患[5][6]。本品列名於世界衛生組織標準藥物清單之中,為基礎醫療系統中最有效且安全的必備藥物之一[7]。在美國,單次療程劑量花費不到25美元[8]。
性质
硝普钠一般以二水合物(Na2[Fe(CN)5NO]·2H2O)的形式出售,它是鲜红色无臭无味的固体或结晶,易溶于水,微溶于醇,其中含有 [Fe(CN)5NO]2− 阴离子,即一个铁原子与五个氰基和一个直线型的亚硝基相配位形成的八面体型配离子。它属于 [Fe(CN)5L]2− 类型,是亚铁氰化物([Fe(CN)6]4−)或铁氰化物([Fe(CN)6]3−)的取代产物,化学性质相当丰富。[9]
该红色钠盐是反磁性的,(N-O)频率出现在1944cm−1处,因此这个化合物应该含有FeⅡ和NO+。阴离子中的铁原子位于四个(-CN)形成的平面上方约20pm处,因此是变形八面体型,Fe-C距离190±5pm,Fe-N距离163±2pm。硝普盐溶液和单晶的电子光谱也被研究过,并为它提出了分子轨道能级图,在其中的一个 π*NO 能级把 eg 和 t2g 能级分隔开了。虽然Fe(Ⅱ)对CN−的反馈程度很小,但Fe(Ⅱ)对NO+的反馈却认为是程度很大的。穆斯堡尔谱学研究表明在铁核上有很高的s电子密度,由此可以认为强的π成键体系使铁的 t2g 电子离域了。
硝普钠二水合物的晶体结构为:[10]
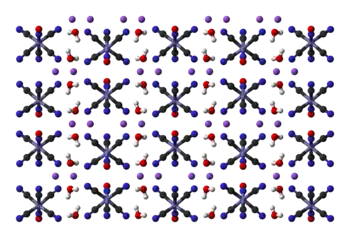
固体对光敏感,易分解产生氰化物。水溶液不稳定,容易分解从褐色变为蓝色。加碱金属氢氧化物(如氢氧化钾)时沉淀出氢氧化铁,生成黄血盐和硝酸钠。
硝普盐与碱反应生成 [Fe(CN)5NO2]4− 离子,与氨反应生成 [Fe(CN)5(NH3)]4−,后者中的铁为+Ⅰ氧化态。
用硫酸沉淀硝普酸钡盐中的钡离子时,可以得到不稳定的硝普酸 H2[Fe(CN)5NO] 微小片晶。
除用作药物之外,硝普钠也用作化学试剂,供测定醛酮、胺、碱金属硫化物、锌、二氧化硫等,以及用于色谱分析中。
- 硝普钠与醛酮的反应称为Legal试验,由E. Legal于1883年发现,发生在硝普钠、α-碳可烯醇化的醛/酮以及氢氧化钠之间,产物为红色,机理 见此。
- 硝普钠与胺的反应称为Rimini试验,由E. Rimini于1898年发现,发生在硝普钠和C1-C4的一级胺、二乙胺或二戊胺之间。与一级胺的反应产生红色化合物,最低检出限量为50μg;与二级胺的反应则生成蓝色化合物。
- 硝普钠也可以与有机硫化物、二硫化物或硫醇作用生成红色产物,这个反应称为Lassaigne试验,最低检出限量为50μg。
- 硝普钠遇到硫离子(S2−)变为紫色的反应称为Gmelin反应,如果用乙醇,还可以分离出紫色固体 Na4[Fe(CN)5N(=O)-S]。一般认为这是一个两步反应,首先是 HS− 加到氮原子上,然后发生-SH基团的去质子化。
- 硝普钠与亚硫酸盐作用产生深红色溶液的反应称为Bodeker反应,原理是生成了 [Fe(CN)5N(O)SO3]4− 离子。
作用机制
亚硝基配体为其中的活性部分。硝普钠一般通过静脉滴注形式给药,在进入血液以后,它便释放出信使分子一氧化氮,一氧化氮能够松弛小动脉与静脉血管平滑肌,降低血压,降低左右心室的前负荷,从而减少左心室的容量及压力。
硝普钠在体内也会迅速代谢为有毒的氰化物,而氰化物又可在肝中与供硫化合物(如硫代硫酸盐)被硫氰酸生成酶代谢为硫氰酸盐,或与正铁血红蛋白反应生成氰化正铁血红蛋白。硫氰酸盐可被肾脏代谢,排泄半衰期为数天。如果硫代硫酸盐含量低,病人肝肾功能不全,或用药超过72小时,氰化物或硫氰酸盐可能发生积累,使病人出现氰化物和硫氰酸盐中毒的迹象,因此静滴时应当及时监控血浆中的硫氰化物浓度。
硝普钠的不良反应有:头痛、腹痛、精神不安、恶心、呕吐、肌肉痉挛、出汗、皮疹、眩晕、发热等。还可导致氰化物中毒和硫氰酸盐中毒——高铁血红蛋白血症、代谢性酸中毒、甲状腺功能衰退和静脉炎。
参考资料
- . The American Society of Health-System Pharmacists. [2016-12-08]. (原始内容存档于2016-12-21).
- Brunton, L.; Chabner, B.; Knollman, B. 12th. New York: McGraw-Hill Professional. 2010. ISBN 978-0-07-162442-8.
- . Drugs.com. 2018 [14 December 2016]. (原始内容存档于21 December 2016).
- Stuart, Mark C.; Kouimtzi, Maria; Hill, Suzanne R. (编). (PDF). World Health Organization. 2009: 283 [8 December 2016]. ISBN 9789241547659. (原始内容存档 (PDF)于13 December 2016).
- Friederich JA, Butterworth JF 4th. . Anesth. Analg. July 1995, 81 (1): 152–162. PMID 7598246. doi:10.1213/00000539-199507000-00031. (原始内容存档于11 December 2013).
- Nichols DG, Greeley WJ, Lappe DG, Ungerleider RM, et al. 2. Elsevier Health Sciences. 2006: 192 [2019-02-25]. ISBN 9780323070072. (原始内容存档于2021-08-29) (英语).
- (PDF). World Health Organization. April 2015 [8 December 2016]. (原始内容存档 (PDF)于13 December 2016).
- Hamilton R. . Jones & Bartlett Learning. 2015: 146. ISBN 9781284057560.
- Coppens, P.; Novozhilova, I.; Kovalevsky, A. "Photoinduced Linkage Isomers of Transition-Metal Nitrosyl Compounds and Related Complexes" Chemical Reviews 2002, volume 102, pp.861-883.doi:10.1021/cr000031c
- A. Navaza, G. Chevrier, P. M. Alzari, P. J. Aymonino. . Acta Cryst. June 1989, 45 (6): 839–841. doi:10.1107/S0108270188013691.
- 谢高阳,俞练民,刘本耀(1998年10月).《无机化学丛书》第九卷 锰分族铁系铂系.北京:科学出版社.页209-210.书号 03-004619-6.