硫氰酸汞
硫氰酸汞也稱為硫氰化汞,化學式Hg(SCN)2,是由硫氰根離子和Hg2+形成的無機化合物。其外觀為白色无臭味的粉末或针状结晶,若是純度較低,顏色會變為灰色。硫氰酸汞是市售的化學品,不過其價格較高[1]。硫氰酸汞曾被應用在爆竹中,當燃燒時硫氰酸汞會膨脹,曲折如蛇形,一般稱為法老之蛇[2]。現今還是有爆竹使用硫氰酸汞,但因為在反應時會產生有毒氣體,多半已不使用。
| 硫氰酸汞 | |
|---|---|
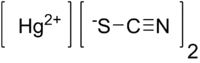 | |
 | |
| 英文名 | |
| 别名 | 硫氰化汞 Mercuric thiocyanate Mercuric sulfocyanate |
| 识别 | |
| CAS号 | 592-85-8 |
| PubChem | 11615 |
| SMILES |
|
| InChI |
|
| InChIKey | GBZANUMDJPCQHY-UHFFFAOYSA-L |
| EINECS | 209-773-0 |
| 性质 | |
| 化学式 | Hg(SCN)2 |
| 316.755 g/mol g·mol⁻¹ | |
| 外观 | 白色至黃褐色单斜晶系粉末 |
| 氣味 | 無味 |
| 密度 | 3.71 g/cm³(固態) |
| 熔点 | 165 °C (分解) |
| 溶解性(水) | 0.069 g/100 mL |
| 溶解性(其他溶劑) | 可溶於稀鹽酸、KCN、氨 微溶於乙醇、醚 |
| 危险性 | |
欧盟危险性符号 剧毒 T+ 剧毒 T+ 危害环境N 危害环境N | |
| 警示术语 | R:R26/27/28, R33, R50/53 |
| 安全术语 | S:S13, S28, S36, S45, S60, S61 |
| NFPA 704 |
 1
3
1
|
| 致死量或浓度: | |
LD50(中位剂量) |
46 mg/kg(老鼠,口服) |
| 相关物质 | |
| 其他阴离子 | 氟化汞 氯化汞 碘化汞 |
| 其他阳离子 | 硫氰酸鉀 硫氰酸鈉 硫氰酸銨 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
合成
最早合成硫氰酸汞的化學家可能是永斯·貝采利烏斯,在1821年合成[2] 。由於硫氰酸汞的離子特性,有許許多製備硫氰酸汞的方法。硫氰酸汞可以由含有汞離子及硫氰酸根離子的溶液反應而成,由於硫氰酸汞對水的溶解度很低,會形成沉澱,但需要注意的是,當硫氰酸根過量時會形成紅色的錯離子而溶於水中。硫氰酸汞可溶於苯、己烷及甲基異丁基酮等有機溶劑中.[3]。大部份合成的方式都會利用硫氰酸汞的沈澱,貝采利烏斯及弗里德里希·维勒是二個早期合成硫氰酸汞的化學家,分別使用以下的方程式合成硫氰酸汞:
- (貝采利烏斯)
- (维勒)
法老之蛇

硫氰酸汞若接觸到足夠的熱源,會有快速的放熱反應,產生大量如蛇一樣捲曲的固體,此一現象稱為法老之蛇。由於此特殊現象,硫氰酸汞曾被用在爆竹中。硫氰酸汞在燃燒時會有不明顯的火焰,可能是藍色、黃色或橙色。形成的固體產物顏色可以從深灰色到淺棕色不等,其內部顏色一般會比外層要暗[2]。
该反应的方程式为:
弗里德里希·維勒在1821年第一次合成硫氰酸汞時,就已經發現此一性質:「(燃燒後)的產物會像蟲一様捲曲,體積較原來增加很多,顏色類似石墨的灰色,但淺很多。」德國一度有販賣一種名為「Pharaoschlange」的爆竹,但後來因為有孩童誤食爆竹燃燒後的固體後死亡,發現燃燒後的產物有毒,後來已禁止販售[2]。
後來有一種稱為黑蛇的爆竹,燃燒後的效果類似法老之蛇,但效果較弱。黑蛇的組成成份的毒性較弱,一般是由碳酸氫鈉和糖或是由亞麻仁油和萘的混合物所構成。
應用及化學性質
硫氰酸汞可用在化學合成中.在合成含硫氰酸根及汞離子的化合物時會用到硫氰酸汞。這類化合物包括硫氰酸汞鉀(K[Hg(SCN)3])及硫氰酸汞銫(Cs[Hg(SCN)3])。Hg(SCN)3-離子也可以獨立存在.和其他合物反應,形成上述的化合物或是其他類似的產物。用紅外光譜學、拉曼光譜學及固態核磁共振進行分析時可以找到這些化合物[4]。
硫氰酸汞也可以用在有機合成中,和有機化合物進行雙分子親核取代反應(SN2反应),用硫氰酸根取代化合物中的鹵素。由於硫氰酸根的二端都會和有機化合物反應,所產生的產物會是二種化合物的混合物,其中一種是硫氰酸根中硫和有機化合物的碳鏈連結,另一種則是用氮元素和有機化合物的碳鏈連結[5]。
當用紫外-可见分光光度法檢測水溶液中的鹵素離子時,加入硫氰酸汞可以提昇其檢測限,此方法在1952年提出,也是後來世界各實驗室檢測鹵素常用的方法。在1964年發明了自動化檢測的系統,位在美國紐約州的Technicon公司在1974年製作了商品化的鹵素分析儀。基本原理是讓待測物的鹵素離子和硫氰酸汞及鐵離子反應。鹵素離子會使硫氰酸汞分解,硫氰酸根和鐵離子產生錯離子Fe(SCN)2+,會吸收450 nm的可見光,可以依此量測Fe(SCN)2+的濃度,再推算鹵素離子的濃度[6]。
1995年時發現另一個用硫氰酸汞檢測水溶液中鹵素離子濃度的方法,此方法只需將硫氰酸汞加入待測物中,不需再加入鐵離子,硫氰酸汞和鹵素離子會形成配合物,吸收254 nm的可見光,其量測的鹵素離子濃度較1952年發現,需要鐵離子的檢測方式要準確[6]。
參考資料
- . Sigma Aldrich.
- Davis, T. L. . Journal of Chemical Education. 1940, 17 (6): 268–270. doi:10.1021/ed017p268.
- Sekine, T.; Ishii, T. (pdf). Bulletin of the Chemical Society of Japan. 1970, 43 (8): 2422–2429. doi:10.1246/bcsj.43.2422.
- Bowmaker, G. A.; Churakov, A. V.; Harris, R. K.; Howard, J. A. K.; Apperley, D. C. . Inorganic Chemistry. 1998, 37 (8): 1734–1743. doi:10.1021/ic9700112.
- Kitamura, T.; Kobayashi, S.; Taniguchi, H. . Journal of Organic Chemistry. 1990, 55 (6): 1801–1805. doi:10.1021/jo00293a025.
- Cirello-Egamino, J.; Brindle, I. D. . Analyst. 1995, 120 (1): 183–186. doi:10.1039/AN9952000183.