硼氢化铝
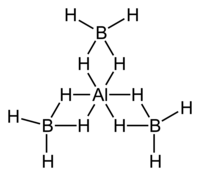
硼氢化铝,又称四氢硼酸铝,是一种无机化合物,化学式为Al(BH4)3。它是一种挥发性易自燃的液体,用于火箭燃料、航空煤油添加剂和实验室用还原剂。与多数离子型的金属硼氢化物不同的是,硼氢化铝是一种共价化合物。[2][3][4]
| 硼氢化铝[1] | |
|---|---|
 | |
| IUPAC名 Aluminium borohydride | |
| 别名 | Aluminum borohydride, aluminium tetrahydroborate, aluminum tetrahydroborate |
| 识别 | |
| CAS号 | 16962-07-5 |
| ChemSpider | 55734 |
| SMILES |
|
| InChI |
|
| InChIKey | LNJYEMMRSAGORU-UHFFFAOYAC |
| 性质 | |
| 化学式 | Al(BH4)3 |
| 71.51 g·mol⁻¹ | |
| 外观 | 无色易燃液体 |
| 熔点 | -64.5 °C(209 K) |
| 沸点 | 44.5 °C(318 K) |
| 溶解性(水) | 与水反应 |
| 危险性 | |
| 闪点 | 自燃 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
性质
硼氢化铝是无色的挥发性液体,是铝化合物中最容易挥发的。[5]它在空气中猛烈氧化,但在真空中,低于25℃缓慢分解,加热至70℃,硼氢化铝分解失去氢,形成不同的挥发性产物:
- Al(BH4)3 → HAl(BH4)2 + [BH3][5]
制备
最早制备硼氢化铝的方法是三甲基铝与过量的乙硼烷发生反应:[5][6]
- Al2(CH3)6 + 4 B2H6 → 2 B(CH3)3 + 2 Al(BH4)3
然而这种方法产率较低,速率又慢,不适用于工业生产,后来被废弃。
- 3 NaBH4 + AlCl3 → Al(BH4)3 + 3 NaCl
- 此反应在100-150℃、无溶剂的条件下反应。若氯化铝过量,则会产生氯化硼氢化铝ClAl(BH4)2或Cl2AlBH4。[5]
而在四氢呋喃中,硼氢化钙与氯化铝的类似反应可制得不易自燃的四氢呋喃加合物:[2]
- 3 Ca(BH4)2 + 2 AlCl3 → 3 CaCl2 + 2 Al(BH4)3
反应
与所有的硼氢化物一样,它是一种还原剂以及负氢提供者。它与水反应生成氢气,[7]并能还原羧酸酯、醛和酮到醇。[2]
硼氢化铝与四甲基锡或四甲基铅剧烈反应,生成固体产物,最终分解成金属单质、氢气、甲基硼烷和一甲基硼氢化铝(CH
3Al(BH
4)
2),但是并未获得二甲基或三甲基取代的硼氢化铝,这可能是取代反应中间体的空间位阻过大所造成的。而该反应的中间体可能是Me2Sn(BH4)2和Me3PbBH4一类的物质。[8]
参考文献
- 97. CRC Press. 2016: 4–44 [2018-07-31]. ISBN 1-4987-5428-7.
- J. Kollonitsch & O. Fuchs. . Nature. 1955, 176 (4492): 1081. doi:10.1038/1761081a0.
- Miwa, K.; Ohba, N.; Towata, S.; Nakamori, Y.; Züttel, A.; Orimo, S. . J. Alloys Compd. 2007,. 446–447: 310–314. doi:10.1016/j.jallcom.2006.11.140.
- Ogg, Richard A.; Ray, James D. . Discussions of the Faraday Society. 1955-01-01, 19: 239. doi:10.1039/df9551900239.
- 《硼氢化合物》.郑学家 主编.化学工业出版社. ISBN 978-7-122-11506-5.第四章 锂、钾、铝、铍、钙、铷及锌的金属硼氢化物
- Hinkamp, James B.; Hnizda, Vincent. . Industrial & Engineering Chemistry. 1955-08-01, 47 (8): 1560–1562. doi:10.1021/ie50548a032.
- Perry, Dale L.; Phillips, Sidney L. . CRC Press. 1995: 3–4 [2007-12-09]. ISBN 0-8493-8671-3.
- Holliday, A.K.; Jeffers, W. . Journal of Inorganic and Nuclear Chemistry. 1958-03-31, 6 (2): 134–137. doi:10.1016/0022-1902(58)80058-5.
扩展阅读
- Fletcher, Edward; Foster, Hampton; Straight, David. . Industrial & Engineering Chemistry. 1959, 51 (11): 1389. doi:10.1021/ie50599a044.
- Hinkamp, James B.; Hnizda, Vincent. . Industrial & Engineering Chemistry. 1955, 47 (8): 1560. doi:10.1021/ie50548a032.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.