碳酸酐酶
碳酸酐酶(英語:,EC 4.2.1.1)又稱碳酸脫水酶(英語:),為催化二氧化碳/水與碳酸間轉換的酵素[1],可維繫血液中的酸鹼平衡與二氧化碳的運輸[2]。此類酵素的活性位點通常有一個鋅離子,因而屬於金屬蛋白,在被研究最多的α型碳酸酐酶中,鋅離子與三個組氨酸的咪唑螯合[3]。
| 碳酸酐酶 | |||||||
|---|---|---|---|---|---|---|---|
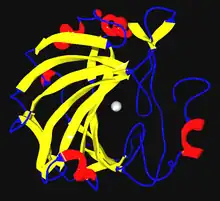 | |||||||
| 人類碳酸酐酶II的結構,中央為一鋅離子 | |||||||
| |||||||
| 识别码 | |||||||
| EC編號 | 4.2.1.1 | ||||||
| CAS号 | 9001-03-0 | ||||||
| 数据库 | |||||||
| IntEnz | IntEnz浏览 | ||||||
| BRENDA | BRENDA入口 | ||||||
| ExPASy | NiceZyme浏览 | ||||||
| KEGG | KEGG入口 | ||||||
| MetaCyc | 代谢路径 | ||||||
| PRIAM | 概述 | ||||||
| PDB | RCSB PDB PDBj PDBe PDBsum | ||||||
| 基因本体 | AmiGO / EGO | ||||||
| |||||||
| 碳酸酐酶(真核生物) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 鑑定 | |||||||||
| 標誌 | Carb_anhydrase | ||||||||
| Pfam | PF00194(旧版) | ||||||||
| InterPro | IPR001148 | ||||||||
| PROSITE | PDOC00146 | ||||||||
| SCOP | 1can / SUPFAM | ||||||||
| 膜蛋白數據庫 | 333 | ||||||||
| |||||||||
碳酸酐酶可催化以下反應:
- CO2 + H2O H
2CO
3 H+ + HCO−
3
- H+ + HCO−
3 H
2CO
3 CO2 + H2O
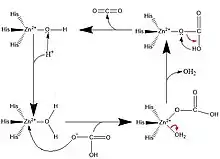
碳酸酐酶催化的反應機理
種類
碳酸酐酶有α、β、γ、δ與ζ等五大類,不同類別碳酸酐酶的氨基酸序列無顯著相似,應是趨同演化的結果。人類的碳酸酐酶屬α型。
近年又有η型與ι型的碳酸酐酶被發現。
α型
脊椎動物、部分藻類與細菌具有α型的碳酸酐酶。
| 碳酸酐酶 | 基因 | 分子量[4] (kDa) |
分布位置 | 人類酵素的效率[lower-alpha 1][5] (s−1) | 對磺酰胺的抑制係數(KI (nM))[5] | |
|---|---|---|---|---|---|---|
| 細胞 | 組織[4] | |||||
| 碳酸酐酶I | CA1 | 29 | 細胞質 | 红血球與消化道 | 2.0 × 105 | 250 |
| 碳酸酐酶II | CA2 | 29 | 細胞質 | 廣泛分布 | 1.4 × 106 | 12 |
| 碳酸酐酶III | CA3 | 29 | 細胞質 | 一型骨骼肌(8%可溶性蛋白均為碳酸酐酶III) | 1.3 × 104 | 240000 |
| 碳酸酐酶IV | CA4 | 35 | 胞外(與糖磷脂酰肌醇相連) | 消化道、腎 | 1.1 × 106 | 74 |
| 碳酸酐酶VA | CA5A | 34.7(估計) | 線粒體 | 肝臟 | 2.9 × 105 | 63 |
| 碳酸酐酶VB | CA5B | 36.4(估計) | 線粒體 | 廣泛分布 | 9.5 × 105 | 54 |
| 碳酸酐酶VI | CA6 | 39–42 | 分泌至胞外 | 唾液與母乳 | 3.4 × 105 | 11 |
| 碳酸酐酶VII | CA7 | 29 | 細胞質 | 廣泛分布 | 9.5 × 105 | 2.5 |
| 碳酸酐酶IX | CA9 | 54, 58 | 细胞膜 | 消化道(數種腫瘤組織亦有分布) | 3.8 × 105 | 16 |
| 碳酸酐酶XII | CA12 | 44 | 活性位点位於胞外 | 腎(數種腫瘤組織亦有分布) | 4.2 × 105 | 5.7 |
| 碳酸酐酶XIII[6] | CA13 | 29 | 細胞質 | 廣泛分布 | 1.5 × 105 | 16 |
| 碳酸酐酶XIV | CA14 | 54 | 活性位点位於胞外 | 腎、心臟、骨骼肌、脑 | 3.1 × 105 | 41 |
| CA-XV[7] | CA15 | 34–36 | 胞外(與糖磷脂酰肌醇相連) | 腎(不存在於人類組織) | 4.7 × 105 | 72 |
γ型
甲烷菌具有γ型碳酸酐酶。
參見
- 碳酸酐酶抑制物
- 玻爾效應
- 碳捕集與封存
註腳
- CA XV除外(為小鼠酵素)
參考文獻
- Badger MR, Price GD. . Annu. Rev. Plant Physiol. Plant Mol. Biol. 1994, 45: 369–392. doi:10.1146/annurev.pp.45.060194.002101.
- . RCSB: PDB-101. [3 December 2018]. (原始内容存档于2022-11-13).
- Krishnamurthy VM, Kaufman GK, Urbach AR, Gitlin I, Gudiksen KL, Weibel DB, Whitesides GM. . Chemical Reviews. March 2008, 108 (3): 946–1051. PMC 2740730
 . PMID 18335973. doi:10.1021/cr050262p.
. PMID 18335973. doi:10.1021/cr050262p. - Unless else specified: Boron WF. . Elsevier/Saunders. 2005. ISBN 978-1-4160-2328-9. Page 638
-
Hilvo M, Baranauskiene L, Salzano AM, Scaloni A, Matulis D, Innocenti A, et al. . The Journal of Biological Chemistry. October 2008, 283 (41): 27799–809. PMID 18703501. doi:10.1074/jbc.M800938200
 .
. - Lehtonen J, Shen B, Vihinen M, Casini A, Scozzafava A, Supuran CT, et al. . The Journal of Biological Chemistry. January 2004, 279 (4): 2719–27. PMID 14600151. doi:10.1074/jbc.M308984200
 .
. - Hilvo M, Tolvanen M, Clark A, Shen B, Shah GN, Waheed A, et al. . The Biochemical Journal. November 2005, 392 (Pt 1): 83–92. PMC 1317667
 . PMID 16083424. doi:10.1042/BJ20051102.
. PMID 16083424. doi:10.1042/BJ20051102. - Sawaya MR, Cannon GC, Heinhorst S, Tanaka S, Williams EB, Yeates TO, Kerfeld CA. . The Journal of Biological Chemistry. March 2006, 281 (11): 7546–55. PMID 16407248. doi:10.1074/jbc.M510464200
 .
. - So AK, Espie GS, Williams EB, Shively JM, Heinhorst S, Cannon GC. . Journal of Bacteriology. February 2004, 186 (3): 623–30. PMC 321498
 . PMID 14729686. doi:10.1128/JB.186.3.623-630.2004.
. PMID 14729686. doi:10.1128/JB.186.3.623-630.2004. - Alterio V, Langella E, Buonanno M, Esposito D, Nocentini A, Berrino E; et al. . Comput Struct Biotechnol J. 2021, 19: 3427–3436. PMC 8217695
 . PMID 34194668. doi:10.1016/j.csbj.2021.05.057.
. PMID 34194668. doi:10.1016/j.csbj.2021.05.057. - Park H, McGinn PJ, More FM. . Aquatic Microbial Ecology. 19 May 2008, 51: 183–193. doi:10.3354/ame01192
 .
. - Del Prete S, Vullo D, Fisher GM, Andrews KT, Poulsen SA, Capasso C, Supuran CT. . Bioorganic & Medicinal Chemistry Letters. September 2014, 24 (18): 4389–4396. PMID 25168745. doi:10.1016/j.bmcl.2014.08.015. hdl:10072/63103
 .
. - Jensen EL, Clement R, Kosta A, Maberly SC, Gontero B. . The ISME Journal. August 2019, 13 (8): 2094–2106. PMC 6776030
 . PMID 31024153. doi:10.1038/s41396-019-0426-8.
. PMID 31024153. doi:10.1038/s41396-019-0426-8. - Del Prete S, Nocentini A, Supuran CT, Capasso C. . Journal of Enzyme Inhibition and Medicinal Chemistry. December 2020, 35 (1): 1060–1068. PMC 7191908
 . PMID 32314608. doi:10.1080/14756366.2020.1755852.
. PMID 32314608. doi:10.1080/14756366.2020.1755852.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.