碳-氧键
碳-氧键是指碳原子和氧原子之间形成的共价键,这是有机化学和生物化学中最常见的化学键之一。[1]氧原子具有6个价电子,倾向于与碳原子共用两个电子形成化学键,剩下的四个非键电子形成两对孤对电子。最简单的含碳-氧键化合物是醇,它们可以看作水的有机衍生物。
碳-氧键是强极性键,电子云明显偏向氧(电负性:碳2.55,氧3.44)。石蜡族的碳–氧键键长平均在143皮米左右,比碳-氮键或碳-碳键都要短。羧酸中单键键长更短(136pm),其中因为共轭效应的存在而具有部分双键的性质。环氧化合物中键长更长(147pm),因为角张力的存在使得电子云不能很好地重叠。[2]碳–氧键的键能也比碳-氮键或碳–碳键大。例如,298K时,甲醇中C-O键键能为91 kcal/mol,甲胺中C-N键键能为87 kcal/mol,而乙烷中C-C键键能为87 kcal/mol。
含有端基碳氧双键官能团的化合物统称为羰基化合物,包括醛、酮、羧酸、羧酸衍生物等等。分子内部的碳氧双键存在于带正电的𨦡盐离子中,但它们多以反应中间体的形式存在。在呋喃及其衍生物中,氧原子的孤对电子参与了p-π共轭,因此呋喃是芳香性的。羰基化合物中碳氧双键的键长约为123 pm。而酰卤中的碳氧双键具有部分三键的性质,因此键长只有 117 pm。常見的碳氧三键只在一氧化碳分子中存在,其中键长很短(112.8 pm)、键能很大。这样的三键键能很大,甚至比氮氮三键的键能还高。[3]氧也可以形成三价的化合物,例如氟硼酸三甲基𨦡。
化学
生成碳-氧键的重要反应有Williamson醚合成、亲核酰基取代反应和烯烃的亲电加成反应。Paternò–Büchi反应相当于羰基进行的复分解反应。
含氧官能团
碳–氧键存在于以下这些官能团中:
| 化学分类 | 键级 | 化学式 | 结构式 | 例子 |
|---|---|---|---|---|
| 醇 | 1 | R3C–OH | 乙醇 | |
| 醚 | 1 | R3C–O–CR3 | 乙醚 | |
| 过氧化物 | 1 | R3C–O–O–CR3 | 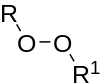 |
二叔丁基过氧化物 |
| 酯 | 1 和 2 | R3C–CO–O–CR3 | 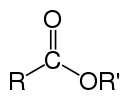 |
丙烯酸乙酯 |
| 碳酸酯 | 1 | R3C–O–CO–O–CR3 | 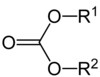 |
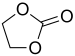 碳酸乙二酯 |
| 酮 | 2 | R3C–CO–CR3 | 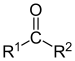 |
丙酮 |
| 醛 | 2 | R3C–CHO | 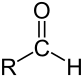 |
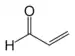 丙烯醛 |
| 羧酸 | 1 和 2 | R3C–COOH | 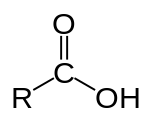 |
 乙酸 |
| 呋喃 | 1.5 | 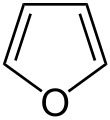 |
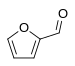 糠醛 | |
| 吡喃鎓盐 | 1.5 | 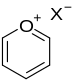 |
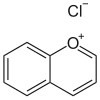 花色苷 | |
参见
- 元素周期表中其他元素与碳形成的化学键:
参考资料
- Organic Chemistry John McMurry 2nd Ed.
- CRC Handbook of Chemistry and Physics 65Th Ed.
- Standard Bond Energies 的存檔,存档日期2016-08-29., Department of Chemistry, Michigan State University
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.