共轭体系
在化學當中,共軛體系是指具有单键-双键交替结构的体系,其中双键的p軌域通过电子离域相互连接,这通常會降低分子的總能量并增加其穩定性。这里的共軛是指由一个σ鍵相隔的p軌域之间发生轨道重疊(如果是大的原子,也可能涉及d軌域)[1]
孤對電子,自由基或碳正離子都可能是此系統的一部分。這些化合物可能是環狀,非環狀,線狀或雜和狀。
一個共軛體系會有一個p軌域重疊,連接其中間的單鍵。它可以讓π電子游離通過所有相鄰對齊的p軌域。[2]此π電子不屬於單鍵或原子,但是屬於一組的原子。
最大的共軛體系是在石墨烯、石墨、導電聚合物和奈米碳管中被發現的。
共轭体系在单键、双键相互交替(以及其他类型)的共轭体系中,由于分子中原子间特殊的相互影响,使分子更加稳定,内能更小键长趋于平均化的效应。
如苯分子中由于相邻的π键电子轨道的交迭而形成共轭,使其六个碳-碳键的键长均为1.39埃。这是分子在没有外界影响下表现的内在性质。
- 分子中,当用经典的价键结构表示时,在出现单双键交替排列结构的部分,一般会出现共轭体系。
- 共轭体系使分子的结构和性质发生变化,表现在:
形成条件: ①各原子都在同一平面上;②这些原子有相互平行的空的p轨道;③p轨道上的电子总数小于p轨道数的2倍。
机制

共軛可能透過單鍵或雙鍵來調控。只要相鄰原子擁有p軌域,此系統可視為共軛。例如呋喃(如圖)是一個擁有兩個會在其中彼此交替轉換的雙鍵和在1號位置上有氧原子的五元環結構。氧有兩對孤對電子,每一對都占據一個p軌域,因此維持一個五元環的共軛。像是羰基(C=O)、亞胺基(C=N)、乙烯基(C=C)、或陰離子中有出現氮元子或α族在環上面將都可以滿足一個π軌域的來源來維持共軛。
也有其他共軛的方式,「同源共軛」[3]是一個由兩個π-系統重疊組成而被非共軛基像是CH2所分開。例如分子CH2=CH–CH2–CH=CH2(1,4-戊二烯)是同源共轭,因為兩個 C=C 雙鍵(這是π系統因為每個雙鍵包含一個π鍵)被一個CH2基分開。[4]
有共軛的環狀化合物

環狀化合物可以是部分或完全的共軛。輪烯是一個完全共軛單環的碳氫化合物,可以是芳香烃,非芳香烃或反芳香烃。
非芳香烃化合物
不是所有單鍵雙鍵之間會互換的化合物都是芳香烃化合物。例如環辛四烯,它擁有單鍵和雙鍵之間的交換。這個化合物是個典型的桶狀結構。由於因為p軌域的分子無法自己對齊而形成非平面分子,所以電子很難輕易的在碳原子中彼此共享。這個分子仍被視為共軛,不過他既不是芳香烃化,也不是反芳香烃(由於它並不是平面的化合物)。
顏料中的共軛體系
共軛體系的獨特特性是能呈現濃厚的顏色。很多顏料利用電子體系(如長鏈碳氫化合物在β-胡萝卜素當中的共軛)製造出鮮豔的橘色。當電子在系統中吸收一個合適波長的光子,它可以被激發到更高的一個能級。[5]。大部分這些電子的躍遷是一個π系統分子軌域(MO)從原本在同能階的偶數電子到另一能階變成基數電子(π 到 π*),但電子從其他能階也能被激發到π系統的MO中(n 到 π*),這種現象經常在電荷轉移復合物中發生。常常HOMO 到 LUMO的躍遷是由電子若依循選擇規則來進行電磁躍遷。共軛體系少於8個共軛的雙鍵的吸收度只有在紫外光範圍,此範圍顏色無法被人類的肉眼看見。每增加一個雙鍵,系統吸收光子的波長就越長(能量越低),化合物顏色的範圍從黃色到紅色。若化合物的顏色是藍色或綠色,那就並不單純是雙鍵的共軛。
在紫外光-可見光的光譜中大量使用了紫外光到可見光的吸光值範圍,它構成了整個光化學的基礎。
共軛體系現在被廣泛地使用在合成顏料和染劑,他們都是重氮化合物、偶氮化物或酞菁化合物。
酞菁化合物
共軛體系不只是可見光範圍中低能量的激發,其也能輕易的接收或提供電子。酞菁類如酞菁藍和酞菁綠,常常包括躍遷金屬離子,也就是電子與錯合的躍遷金屬離子輕易的改變其氧化態。像這些顏料和染劑都是電荷轉移配合物。
卟啉與相似的化合物
卟啉有共軛分子的環狀系統(大环)出現在很多生物體的酵素當中。像是配體,卟啉和金屬離子如鐵離子在血紅素中組成大量的錯合物讓血液呈紅色。血紅素是運送氧氣到我們全身的細胞。卟啉和金屬的錯合物常常有鮮艷的顏色。一個類似的環狀結構分子二氢卟吩是相似於由鐵離子構成的錯合物,只是鐵由鎂離子取代。此組成最常見的就是葉綠素分子,顧名思義其顏色是綠色的。另一個類似的大环结构是二氢卟吩,其與鈷離子錯合,當行程部分的鈷胺素分子時,其會組成维生素B12,其為深紅色。咕啉單體有六個共軛雙鍵,不過並不是圍繞整個大分子環都是共軛。
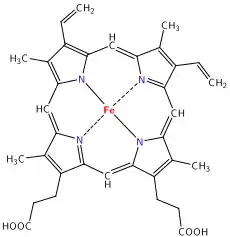 |  | 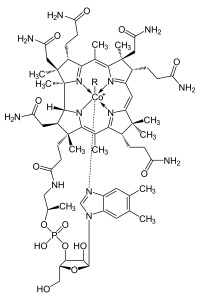 |
| 血紅素中血基質的結構 | 二氢卟吩為葉綠素a的一部分。 綠色框框為不同葉綠素中所擁有的不同官能基 | 鈷胺素的結構是包括二氢卟吩的大分子環狀物。 |
參考文獻
- IUPAC Gold Book - conjugated system (conjugation) (页面存档备份,存于)
- March Jerry; (1985). Advanced Organic Chemistry reactions, mechanisms and structure (3rd ed.). New York: John Wiley & Sons, inc. ISBN 0-471-85472-7
- . [2013-06-30]. (原始内容存档于2016-08-03).
- Some orbital overlap is possible even between bonds separated by one (or more) CH2 because the bonding electrons occupy orbitals which are quantum-mechanical functions and extend indefinitely in space. Macroscopic drawings and models with sharp boundaries are misleading because they do not show this aspect.
- 請參考《盒子中的粒子》(particle in a box)