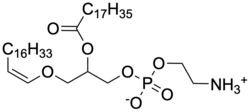
缩醛磷脂
甘油磷脂在 sn-1 位上存在三类取代基:酰基、烷基和烯基。 [1]其中,烷基和烯基与甘油形成醚键,分别形成烷基磷脂(sn-1 为烷基取代)和烯基磷脂(sn-1 为乙烯基)。缩醛磷脂是在甘油主链的 sn-2 位有酯键的烯基磷脂。 [2] [3]通过 sn-1 位醚键相连的的脂肪链可以是 C16:0、C18:0 (饱和)或 C18:1(单不饱和), [4] [2]通过 sn-2 位酰基相连的脂肪链可以为 C22:6 ω-3(二十二碳六烯酸)或 C20:4 ω-6(花生四烯酸)。 [5]缩醛磷脂可根据其头部基团分类,主要为胆碱缩醛磷脂和乙醇胺缩醛磷脂。 [6] [7]
功能
成年人心脏中 32% 的甘油磷脂、大脑中 20% 的甘油磷脂和 70% 的髓鞘乙醇胺甘油磷脂是缩醛磷脂。 [11]
尽管缩醛磷脂的功能尚未被完全阐明,但已证实其可保护哺乳动物细胞免受活性氧的破坏。 [8] [9] [10]此外,缩醛磷脂也被认为是信号分子和膜动力学调节剂。
历史
1924 年,缩醛磷脂首次在 Feulgen 和 Voit 对组织切片的研究中被提出。 [8] 他们用酸或氯化汞处理组织切片,以对细胞核进行染色。在此过程中,缩醛磷脂的乙烯基醚键断裂产生醛类,后者与核染色过程中同时使用的品红-亚硫酸染剂发生反应,进而在细胞质内产生有色化合物。缩醛磷脂就是因此种有色化合物存在于血浆或细胞中而得名的。 [8]
生物合成

缩醛磷脂的生物合成从位于过氧化物酶体膜腔侧的过氧化物酶体基质酶 GNPAT (磷酸甘油酯O-酰基转移酶)和AGPS (烷基甘油磷酸合成酶)的结合开始。 [12]这两种酶可以相互促进,因此不具有 AGPS 活性的成纤维细胞 的 GNPAT 活性与表达水平也都更低。 [13] [14]
具体来说,合成起始于 GNPAT 酰基化二羟丙酮磷酸的 sn-1 位,随后 AGPS 将酰基替换为烷基。 [15]之后在过氧化物酶体和内质网膜中,酰基/烷基二羟基丙酮磷酸还原酶将 1-烷基-DHAP二羟基丙酮磷酸 还原为 1-O-烷基-2-羟基-sn-甘油磷酸 (GPA)。 [16]此外的所有其他修饰都在内质网中完成:烷基/酰基GPA酰基转移酶酰基化 sn-2 位,随后磷酸基团被磷脂酸磷酸酶除去,形成 1-O-烷基-2-酰基-sn-甘油。
对于磷脂酰乙醇胺,在上述过程的基础上,由磷酸转移酶参与催化与 CDP-乙醇胺 合成 1-O-烷基-2-酰基-sn-甘油磷酸乙醇胺。之后再由电子传递链和磷脂酰乙醇胺去饱和酶在烷基的1、2位脱氢,以最后形成缩醛磷脂的乙烯基醚键。在不同生物中,均有发现与磷脂酰乙醇胺去饱和酶对应的蛋白,在细菌中为 CarF,在人类和动物中为 PEDS1 (TMEM189)。 [17] [18] 对于磷脂酰胆碱,则需要进一步由胆碱磷酸转移酶进行合成。由于不存在磷脂酰胆碱去饱和酶,胆碱缩醛磷脂只能在乙醇胺缩醛磷脂水解为 1-O-(1Z-烯基)-2-酰基-sn-甘油 后,再由胆碱磷酸转移酶催化和 CDP-胆碱 合成。 [19] [20]
病理作用
过氧化物酶体生物合成障碍 是一种常染色体隐性遗传病,常以缩醛磷脂生物合成受阻为特征。对患者而言,生物合成过程起始所必需的过氧化物酶体酶 GNPAT 错误分布于细胞质中,而其在胞质中是无活性的。此外, GNPAT 或 AGPS 发生基因突变也可导致缩醛磷脂缺乏,从而分别导致 2 型和 3 型根状软骨发育不良 (RCDP) 。 [21] 这种情况下, GNPAT 或 AGPS 的两个等位基因都必须突变才能引发疾病。与过氧化物酶体生物合成障碍不同,RCDP2 和 RCDP3 患者中过氧化物酶体的其他组装过程完全正常,因此代谢长链脂肪酸的能力不受影响。患有严重缩醛磷脂缺乏症的个体常表现出神经发育异常、骨骼畸形、呼吸受损和白内障等症状。 [22]
缩醛磷脂的缺乏有助于诊断 Zellweger 综合征。 [20]
潜在相关疾病
除了RCDP和Zellweger 综合征,尽管缩醛磷脂确实也有参与到其他疾病的生理过程中,但由于缺乏测定手段,对其参与过程的具体评估较为困难。 [20] 一些人类证据表明,缩醛磷脂水平低与支气管肺发育不良的发病原理有关,后者是早产的重要并发症之一。 [20] 另一项研究显示,与不吸烟者相比,吸烟的慢性阻塞性肺病患者的缩醛磷脂水平更低。来自人类和动物的一些证据表明,在包括阿尔茨海默病、帕金森病、C 型尼曼皮克氏病、唐氏综合症和多发性硬化症在内的神经退行性疾病中,大脑中缩醛磷脂的水平都会降低,但尚不清楚是否有因果关系。 [20] 此外,一项针对小鼠的研究指出,缩醛磷脂可以清除衰老相关的突触缺陷。 [27]
进化过程
除哺乳动物外,缩醛磷脂还存在于无脊椎动物和单细胞原生动物中。在厌氧细菌中,缩醛磷脂存在于梭状芽胞杆菌、巨球菌和韦荣氏菌等细菌中。在好氧细菌中,缩醛磷脂存在于粘细菌中。其中合成乙烯基醚键、进而合成缩醛磷脂所需的磷脂酰乙醇胺去饱和酶 (CarF),在人和动物中以 TMEM189保留下来。 [17] 已有研究证明,醛磷脂有复杂的进化史,因为其生物合成途径在好氧和厌氧生物中并不相同。 [28]
最近,已证明人类和类人猿(黑猩猩、倭黑猩猩、大猩猩和猩猩)红细胞中的缩醛磷脂成分存在差异。 [10]人类的总红细胞缩醛磷脂水平低于倭黑猩猩、黑猩猩或大猩猩,但高于猩猩。通过这些物种的基因表达数,作者推测人类和类人猿细胞和组织的缩醛磷脂水平不同。尽管尚不清楚这些潜在差异的后果,但组织缩醛磷脂的跨物种差异可能确实会影响不同的器官功能和生物过程。
参见
- 醚酯
参考
- Yamashita S, Honjo A, Aruga M, Nakagawa K, Miyazawa T. . J Oleo Sci. 2014, 63 (5): 423–30. PMID 24717546. doi:10.5650/jos.ess13188.
- Wallner S, Schmitz G. . Chem Phys Lipids. September 2011, 164 (6): 573–89. PMID 21723266. doi:10.1016/j.chemphyslip.2011.06.008.
- Hu C, Wang M, Han X. . Redox Biol. August 2017, 12: 946–955. PMC 5423350
 . PMID 28494428. doi:10.1016/j.redox.2017.04.030.
. PMID 28494428. doi:10.1016/j.redox.2017.04.030. - Braverman NE, Moser AB. . Biochim Biophys Acta. September 2012, 1822 (9): 1442–52. PMID 22627108. doi:10.1016/j.bbadis.2012.05.008.
- Fuchs B. . Free Radic Res. May 2015, 49 (5): 599–617. PMID 25536419. S2CID 5443009. doi:10.3109/10715762.2014.999675.
- Maeba R, Nishimukai M, Sakasegawa S, Sugimori D, Hara H. . Adv Clin Chem. 2015, 70: 31–94. PMID 26231485. doi:10.1016/bs.acc.2015.03.005.
- Messias, Márcia Cristina Fernandes; Mecatti, Giovana Colozza; Priolli, Denise Gonçalves; De Oliveira Carvalho, Patrícia. . Lipids in Health and Disease. 2018, 17 (1): 41. PMC 5842581
 . PMID 29514688. doi:10.1186/s12944-018-0685-9.
. PMID 29514688. doi:10.1186/s12944-018-0685-9. - Nagan, N.; Zoeller, R. A. . Progress in Lipid Research. 2001, 40 (3): 199–229. PMID 11275267. doi:10.1016/S0163-7827(01)00003-0.
- Gorgas, K.; Teigler, A.; Komljenovic, D.; Just, W. W. . Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 2006, 1763 (12): 1511–26. PMID 17027098. doi:10.1016/j.bbamcr.2006.08.038
 .
. - Moser, A. B.; Steinberg, S. J.; Watkins, P. A.; Moser, H. W.; Ramaswamy, K.; Siegmund, K. D.; Lee, D. R.; Ely, J. J.; Ryder, O. A.; Hacia, J. G. . Lipids in Health and Disease. 2011, 10: 101. PMC 3129581
 . PMID 21679470. doi:10.1186/1476-511X-10-101.
. PMID 21679470. doi:10.1186/1476-511X-10-101. - Farooqui, A. A.; Horrocks, L. A. . The Neuroscientist. 2001, 7 (3): 232–245. PMID 11499402. S2CID 85868497. doi:10.1177/107385840100700308.
- Brites P, Waterham HR, Wanders RJ. . Biochim Biophys Acta. March 2004, 1636 (2–3): 219–31. PMID 15164770. doi:10.1016/j.bbalip.2003.12.010.
- Biermann J, Just WW, Wanders RJ, Van Den Bosch H. . Eur J Biochem. April 1999, 261 (2): 492–9. PMID 10215861. doi:10.1046/j.1432-1327.1999.00295.x.
- Hardeman D, van den Bosch H. . Biochim Biophys Acta. November 1989, 1006 (1): 1–8. PMID 2804060. doi:10.1016/0005-2760(89)90315-9.
- Brown AJ, Snyder F. . J Biol Chem. August 1982, 257 (15): 8835–9. PMID 7096336. doi:10.1016/S0021-9258(18)34205-4
 .
. - James PF, Lake AC, Hajra AK, Larkins LK, Robinson M, Buchanan FG, Zoeller RA. . J Biol Chem. September 1997, 272 (38): 23540–6. PMID 9295290. doi:10.1074/jbc.272.38.23540
 .
. - Gallego-García A, Monera-Girona AJ, Pajares-Martínez E, Bastida-Martínez E, Pérez-Castaño R, Iniesta AA, Fontes M, Padmanabhan S, Elías-Arnanz M. . Science. 2019, 366 (6461): 128–132. Bibcode:2019Sci...366..128G. PMID 31604315. S2CID 203717749. doi:10.1126/science.aay1436.
- Werner, ER; Keller, MA; Sailer, S; Lackner, K; Koch, J; Hermann, M; Coassin, S; Golderer, G; Werner-Felmayer, G; Zoeller, RA; Hulo, N. . Proceedings of the National Academy of Sciences of the United States of America. 7 April 2020, 117 (14): 7792–7798. PMC 7149458
 . PMID 32209662. doi:10.1073/pnas.1917461117
. PMID 32209662. doi:10.1073/pnas.1917461117  .
. - Lee TC. . Biochim Biophys Acta. November 1998, 1394 (2–3): 129–45. PMID 9795186. doi:10.1016/s0005-2760(98)00107-6.
- Braverman, NE; Moser, AB. . Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. September 2012, 1822 (9): 1442–52. PMID 22627108. doi:10.1016/j.bbadis.2012.05.008
 .
. - Wanders, R.; Waterham, H. . Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 2006, 1763 (12): 1707–20. PMID 17055078. doi:10.1016/j.bbamcr.2006.08.010
 .
. - Braverman NE, Steinberg SJ, Fallatah W, et al. . GeneReviews® [Internet] (University of Washington). 2020 [2022-07-04]. PMID 20301447. NBK1270. (原始内容存档于2017-01-18).
- Rodemer C, Thai TP, Brugger B, Kaercher T, Werner H, Nave KA, Wieland F, Gorgas K, Just WW. . Hum Mol Genet. August 2003, 12 (15): 1881–95. PMID 12874108. doi:10.1093/hmg/ddg191.
- Zou, Yilong; Henry, Whitney S.; Ricq, Emily L.; Graham, Emily T.; Phadnis, Vaishnavi V.; Maretich, Pema; Paradkar, Sateja; Boehnke, Natalie; Deik, Amy A.; Reinhardt, Ferenc; Eaton, John K. . Nature. September 2020, 585 (7826): 603–8. Bibcode:2020Natur.585..603Z. PMC 8051864
 . PMID 32939090. doi:10.1038/s41586-020-2732-8.
. PMID 32939090. doi:10.1038/s41586-020-2732-8. - Xin S, Mueller C, Pfeiffer S, Kraft VA, Merl-Pham J, Bao X, Feederle R, Jin X, Hauck SM, Schmitt-Kopplin P, Schick JA. . Cell Death Differ. March 2022, 29 (3): 670–686. PMC 8901757
 . PMID 34663908. S2CID 239025829. doi:10.1038/s41418-021-00883-z.
. PMID 34663908. S2CID 239025829. doi:10.1038/s41418-021-00883-z. - Albert, Carolyn J.; Crowley, Jan R.; Hsu, Fong-Fu; Thukkani, Arun K.; Ford, David A. . Journal of Biological Chemistry. 2001-06-29, 276 (26): 23733–41. PMID 11301330. doi:10.1074/jbc.M101447200
 (英语).
(英语). - Gu, Jinxin; Chen, Lixue; Sun, Ran; Wang, Jie-Li; Wang, Juntao; Lin, Yingjun; Lei, Shuwen; Zhang, Yang; Lv, Dan; Jiang, Faqin; Deng, Yuru. . Front. Mol. Biosci. 2022, 9: 815320. PMC 8906368
 . PMID 35281262. doi:10.3389/fmolb.2022.815320
. PMID 35281262. doi:10.3389/fmolb.2022.815320  .
. - Goldfine, H. . Progress in Lipid Research. 2010, 49 (4): 493–498 [2022-07-04]. PMID 20637230. doi:10.1016/j.plipres.2010.07.003. (原始内容存档于2022-07-07).