莫努匹韋
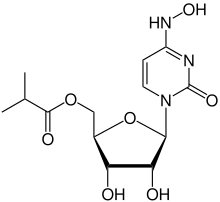
莫努匹韋(英語:[1],商品名称:利卓瑞/LAGEVRIO[2])是由美国默克藥廠與瑞奇貝克生物技术公司共同开发的一种抗病毒药物,可口服[3]。最初研發目的是用作治療流行性感冒,因其增加病毒基因變異的風險[4]而被放棄,後來被用作治疗2019冠状病毒病(COVID-19)。它是人工合成的核苷衍生物 N4-羟基胞苷 (N4-hydroxycytidine)的前体药物,在病毒核糖核酸复制过程中引入“复制错误”来发挥其抗病毒作用。莫納皮拉韋的口服藥是美国疾控中心推荐用来治疗2019冠状病毒病(COVID-19)的药物之一,需在症状出现后的5天内开始服用[5]。
 | |
| 臨床資料 | |
|---|---|
| 商品名 | 利卓瑞 LAGEVRIO |
| 其他名稱 | MK-4482, EIDD-2801 |
| 法律規範狀態 | |
| 法律規範 |
|
| 识别 | |
| |
| CAS号 | 2349386-89-4 |
| PubChem CID | |
| DrugBank | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| 化学 | |
| 化学式 | C13H19N3O7 |
| 摩尔质量 | 329.31 |
| 3D模型(JSmol) | |
| |
| |
| 「莫努匹韋」的各地常用名稱 | |
|---|---|
| 中国大陸 | |
| 臺灣 | |
| 港澳 | |
医用信息
授權
2021年10月27日,藥品專利池與默沙東藥廠宣布達成協議,默沙東將根據協議授權經審批的藥廠生產莫努匹韋的仿製藥,用於供應協議指定的中低收入發展中國家,而無需支付專利費,使中低收入國家更容易取得足夠藥物應對疫情[11]。
採用
美国
美国食品药品监督管理局于2021年12月23日批准莫納皮拉韋在无其他治疗新冠选项情况下的紧急使用。[3][14]
香港
莫納皮拉韋在香港與帕昔洛韋作互補使用,雖然莫努匹韋的效能不及後者,但與其他藥物發生交互作用的情況較少,對於當前需要服用治療長期病藥物的病人,莫努匹韋比帕昔洛韋可提供較大的用藥彈性[20]。
2022年4月26日起,莫努匹韋可免費分發予私家醫生,私家醫生需要預先登記,當獲得分發莫努匹韋後,再按照用藥指引處方給指定的病人,而私家醫生不得向病人收取莫努匹韋的藥費[21]。
2022年10月5日,香港大學李嘉誠醫學院與香港中文大學醫學院發表聯合報告,分析香港在2022年2月至3月的第五波疫情期間,在指定診所或於公立醫院接受治療的54,355名患者,包括60歲或以上的患者,以及60歲以下患有一種或以上長期病患的病人,當中兩成病人獲處方新型冠狀病毒口服藥。研究團隊發現住院治療的病人,獲處方輝瑞藥廠的帕昔洛韋(Paxlovid)或默沙東藥廠的莫努匹韋後,死亡風險較一般治療降低76%,當中單一使用帕昔洛韋的患者可降低死亡風險90%,而單一使用莫努匹韋的病人死亡風險則下降69%。對於到指定診所接受診治的的患者,獲處方其中任何一種口服藥後,28天內入院的風險降低88%,單一使用帕昔洛韋可減少入院率達63%,而莫努匹韋也可降低28%的入院率。獲處方上述任何一種口服藥物的住院病人,28天內經急症室再入院率減少21%,帕昔洛韋可減少53%;莫努匹韋則減少29%,而研究結果已刊登於《刺針》醫學期刊[22]。
參考文獻
- . 世卫组织网站新闻稿 (世卫组织). 2022-03-03 [2022-12-30]. (原始内容存档于2022-04-15).
- . www.nmpa.gov.cn. [2022-12-30]. (原始内容存档于2022-12-31).
- Office of the Commissioner. . 美国食品药品监督管理局(FDA). 2021-12-23. (原始内容存档于2021-12-23) (英语).
- Donovan-Banfield, I’ah; Penrice-Randal, Rebekah; Goldswain, Hannah; Rzeszutek, Aleksandra M.; Pilgrim, Jack; Bullock, Katie; Saunders, Geoffrey; Northey, Josh; Dong, Xiaofeng; Ryan, Yan; Reynolds, Helen. . Nature Communications. 2022-11-26, 13 (1) [2023-01-12]. ISSN 2041-1723. doi:10.1038/s41467-022-34839-9. (原始内容存档于2023-01-12) (英语).
- . 美国疾控中心(CDC). 2022-12-05. (原始内容存档于2022-01-04) (美国英语).
- . [2021-10-02]. (原始内容存档于2021-10-01).
- . GOV.UK. [2021-12-21]. (原始内容存档于2021-11-04) (英语).
- (PDF). Merck & Co., Inc. 23 December 2021. (原始内容存档于24 December 2021).
- Katella, Kathy. . Yale Medicine. 2022-01-05. (原始内容存档于2023-09-27) (英语).
- . 美国食品药品监督管理局(FDA). 2022-06 [2023-01-11]. (原始内容存档于2023-03-22).
- . Medicines Patent Pool. 2021-10-27 [2023-01-03]. (原始内容存档于2023-03-24).
- . GOV.UK. [2021-12-21]. (原始内容存档于2022-01-05) (英语).
- . BBC. 2021-11-11 [2021-11-12]. (原始内容存档于2022-06-06).
- . [2021-12-23]. (原始内容存档于2022-05-12).
- . [2022-04-22]. (原始内容存档于2022-01-24).
- . [2022-04-22]. (原始内容存档于2022-01-12).
- . [2022-04-22]. (原始内容存档于2022-04-23).
- . [2022-04-22]. (原始内容存档于2022-04-22).
- . [2022-04-22]. (原始内容存档于2022-04-22).
- . Medical Inspire. 2022-03-17 [2022-08-22].
- . 星島日報. 2022-04-26 [2022-08-22]. (原始内容存档于2022-08-22).
- . 中大新聞中心 (香港中文大學). 2022-10-05 [2022-12-30]. (原始内容存档于2022-12-30).
- . [2022-06-09]. (原始内容存档于2022-05-25).
- . 经济观察网. [2023-01-20]. (原始内容存档于2023-01-20).
- . [2023-01-13]. (原始内容存档于2023-01-13).