酞菁
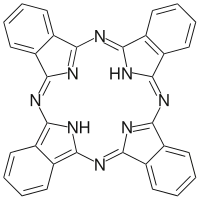
酞菁(Phthalocyanine),是一类大环化合物,环内有一个空腔,直径约2.7 × 10−10m。中心腔内的两个氢原子可以被70多种元素取代,包括几乎所有的金属元素和一部分非金属元素。酞菁环的配位数是四,依金属的原子尺寸和氧化态,一个或两个(对部分碱金属而言)金属原子可以嵌入酞菁的中心腔内。如果金属趋向于更高的配位数,金属酞菁的分子会呈角锥体,四面体或八面体结构。锕系和镧系金属是八配位的,这两个系的金属酞菁呈现三明治型结构。
| 酞菁(母核) | |
|---|---|
 | |
| 英文名 | |
| 识别 | |
| CAS号 | 574-93-6 |
| PubChem | 5282330 |
| ChemSpider | 4445497 |
| SMILES |
|
| InChI |
|
| InChIKey | IEQIEDJGQAUEQZ-UHFFFAOYAC |
| 性质 | |
| 化学式 | C32H18N8 |
| 514.54 g·mol⁻¹ | |
| 外观 | 深蓝色、紫色至黑色结晶 |
| 熔点 | > 300 °C |
| 沸点 | 550 °C (升华) |
| 溶解性 | 难溶于水,溶于硫酸 |
| 危险性 | |
| 安全术语 | S:S22, S24/25 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
历史
1907年Braun和Tehemiac两人[1]在一次实验中偶然得到了一种蓝色物质,当时他们两人正在研究邻氰基苯甲酰胺的化学性质,当他们将这种无色的物质加热后得到了微量的蓝色物质,这就是现在被人们称为酞菁的化合物。1923年Diesbach等人[2]发现可以用邻二苄溴与氰化亚铜反应制得邻二苄腈,于是他们想用邻二溴苯与氰化亚铜反应来制备邻苯二腈。可实验结果出乎他们的意料,他们并未得到所期望的邻苯二腈,而是得到一种深蓝色的物质,并且产率达到23%。这种蓝色物质就是现在被称为酞菁铜的化合物。至此,酞菁和金属酞菁化合物被发现。直到1929年,在英国的ICI公司的资助下,英国伦敦大学的Linstead教授和他的合作者开始进行这类新物质的结构测定工作。1933年他们用元素分析、质谱和氧化降解(分解产物确定为邻苯二甲酰亚胺)等手段测定了该类化合物的结构,Linstead教授便用phthalocyanine(Pc)一词来描述这类新化合物。
概述
1935年Linstead教授和他的合作者采用500℃以上的高温和低气压,用CO2作载气制得了酞菁化合物的单晶。Robertson教授用X射线衍射分析法对酞菁及几种金属酞菁(包括镍酞菁,铜酞菁和铂酞菁)的单晶进行结构分析,根据他的报道,酞菁及镍酞菁、铜酞菁和铂酞菁等的分子所组成的晶体属单斜晶体,空间群为P2/a。每个晶胞中有两个酞菁分子,每个酞菁分子都呈现出高度平面的结构。所得分子结构的结果与Linstead教授的结果完全一致,从而酞菁的化学结构得到了进一步的证实。酞菁环本身是一个具有18个π电子的大π体系,因此其电子密度非常均匀,以致分子中的四个苯环很少变形,并且各个C-N键的键长几乎相等。它可以看做是四苯并卟啉的四氮杂衍生物。
酞菁是一类大环化合物,环内有一个空腔,直径约2.7 × 10−10m。中心腔内的两个氢原子可以被70多种元素取代,包括几乎所有的金属元素和一部分非金属元素。酞菁环的配位数是四,依金属的原子尺寸和氧化态,一个或两个(对部分碱金属而言)金属原子可以嵌入酞菁的中心腔内。如果金属趋向于更高的配位数,金属酞菁的分子会呈角锥体,四面体或八面体结构。锕系和镧系金属是八配位的,这两个系的金属酞菁呈现三明治型结构。
酞菁分子中心是一个由碳氮共轭双键组成的18-π体系,它的吸收谱可见区680nm和近紫外区340nm处有强吸收峰,分别称作Q带和B带(Soret带)这两个带尤其是Q带是酞菁类化合物的特征吸收带,可以作为酞菁成环的标志。
酞菁是第一个使用X射线技术确定结构的有机化合物,酞菁存在强的电子流,满足了高分辨电子显微镜的要求,可以得到分子和亚分子分辨的有机分子图象。大多数酞菁化合物具有同质多晶性,即结构相同的酞菁分子在不同的环境中所生成的晶体结构是不同的。这些特殊晶型的酞菁被作为光导体材料用在电子照相和激光打印机上。酞菁的电性质研究表明,该类化合物是一种有机半导体,带隙宽度为1.5ev左右,一般是p型半导体,通过改变酞菁环上的取代基和中心金属的类型可以修饰或改变酞菁的性能,得到性能各异的功能材料,当酞菁周边的取代基连上强拉电子取代基如 -F 和 -CN 等时,甚至可以转化为n型半导体。
合成
酞菁通常由邻苯二酰衍生物的环化四聚合反应合成,即邻苯二甲酸、邻苯二甲酸酐、邻苯二甲酰亚胺、邻苯二腈、1,2-二溴苯或1,3-二亚氨基异吲哚啉。制备金属衍生物最常用的方法是邻苯二腈的金属模板反应,而1,3-二亚氨基异吲哚啉是用于获得非金属酞菁。制备非金属酞菁的另一种方法是用醇钠或醇锂处理邻苯二腈,可以得到碱金属酞菁,紧接着用无机酸去掉金属得到非金属酞菁。而且,在对苯二酚、四氢嘧啶存在下加热邻苯二腈可获得非金属酞菁。目前,最常用的方法是通过邻苯二腈和异吲哚啉在高沸点有机溶剂中合成酞菁,用这两种前体合成酞菁的优势在于易提纯及产率较高。

相关化合物

参考资料
- A. Braun, J. Tcherniac. . Berichte der deutschen chemischen Gesellschaft. 1907, 40 (2): 2709–2714. doi:10.1002/cber.190704002202.
- Henri de Diesbach, Edmond von der Weid. . Helvetica Chimica Acta. 1927, 10 (1): 886–888. doi:10.1002/hlca.192701001110.