酰胺基磷酸核糖基转移酶
酰胺基磷酸核糖基转移酶(英语:amidophosphoribosyltransferase,简写:ATase),也称为谷氨酰胺磷酸核糖基焦磷酸酰胺基转移酶 (英语:glutamine phosphoribosylpyrophosphate amidotransferase,简写:GPAT),是一种利用来自谷氨酰胺侧链的胺基团催化5-磷酸核糖-1-焦磷酸(PRPP)转化为5-磷酸核糖-1-胺(PRA)的酶。这是从头合成嘌呤的关键步骤。在人类中,它由 PPAT(磷酸核糖焦磷酸氨基转移酶)基因编码。[6][7]ATase是嘌呤/嘧啶磷酸核糖基转移酶(PRTase)家族的成员。
结构核功能
| 酰胺基磷酸核糖基转移酶 | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| 识别码 | |||||||
| EC編號 | 2.4.2.14 | ||||||
| CAS号 | 9031-82-7 | ||||||
| 数据库 | |||||||
| IntEnz | IntEnz浏览 | ||||||
| BRENDA | BRENDA入口 | ||||||
| ExPASy | NiceZyme浏览 | ||||||
| KEGG | KEGG入口 | ||||||
| MetaCyc | 代谢路径 | ||||||
| PRIAM | 概述 | ||||||
| PDB | RCSB PDB PDBj PDBe PDBsum | ||||||
| 基因本体 | AmiGO / EGO | ||||||
| |||||||
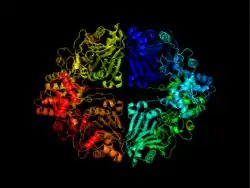
该酶由两个结构域组成:通过水解从谷氨酰胺产生氨的谷氨酰胺酶结构域和将氨与核糖-5-磷酸结合的磷酸核糖基转移酶结构域。[8]酶的两个活性位点之间的协调使其具有特殊的复杂性。
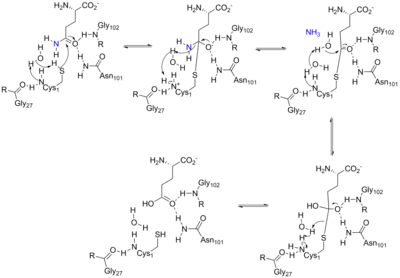
谷氨酰胺酶结构域与其他N端亲核体 (Ntn) 水解酶如氨甲酰磷酸合成酶 (CPSase) 同源。所有Ntn酰胺基转移酶序列中的九个不变残基在关键的催化、底物结合或结构发挥作用。末端半胱氨酸残基在反应的第一部分充当亲核试剂,类似于催化三联体的半胱氨酸。[8][9]游离的N末端充当碱基以激活亲核试剂并使水解反应中的离去基团(在这种情况下为氨)质子化。催化位点的另一个关键方面是催化反应中间体的氧阴离子空穴,如下面的机制所示。[10]
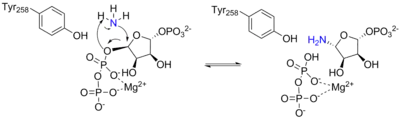
PRTase结构域与参与嘌呤核苷酸合成和补救途径的许多其他PRTase同源。所有PRTase都涉及通过各种亲核体置换PRPP中的焦磷酸盐。[11] ATase是唯一具有氨作为亲核体的PRTase。[8]PRPP中的焦磷酸盐是一个极好的离去基团,因此几乎不需要化学助剂来促进催化。相反,酶的主要功能似乎是将反应物适当地聚集在一起并防止错误的反应,例如水解。[8]
除了具有各自的催化能力外,这两个结构域还相互协调,以确保由谷氨酰胺产生的所有氨都转移到PRPP,并且除氨外没有其他亲核体攻击PRPP。这主要通过阻止氨的形成直到PRPP结合并将氨引导至PRTase活性位点来实现。[8]
PRPP对酶的初始激活是由“谷氨酰胺环”中的构象变化引起的,该环重新定位以能够接受谷氨酰胺。这导致谷氨酰胺结合的Km值高出200倍。[12]一旦谷氨酰胺与活性位点结合,进一步的构象变化会将位点带入酶,使其无法进入。[8]
这些构象变化还导致20Å长的氨通道的形成,这是这种酶最显着的特征之一。该通道没有任何氢键位点,以确保氨从一个活性位点轻松扩散到另一个活性位点。该通道确保从谷氨酰胺释放的氨到达PRTase催化位点,并且它与CPSase中的通道不同,[13]它是疏水的而不是极性的,是暂时的而不是永久的。[8]
反应机制
ATase催化的总反应如下:
- PRPP + 谷氨酰胺 → PRA + 谷氨酸 + PPi
在酶内,反应被分解成两个半反应,发生在不同的活性位点:
- 谷氨酰胺 → NH
3 + 谷氨酸 - PRPP + NH
3 → PRA + PPi
该机制的第一部分发生在谷氨酰胺酶结构域的活性位点,并通过水解从谷氨酰胺中释放出一个氨基团。第一个反应释放的氨然后通过20Å通道转移到磷酸核糖基转移酶结构域的活性位点,然后与PRPP结合形成PRA。
调节
在反馈抑制的一个例子中,ATase主要受到嘌呤合成途径的终产物AMP、GMP、ADP和GDP的抑制。[8]来自同型四聚体的每个酶亚基具有这些抑制剂的两个结合位点。别构(A)位点与PRPP的核糖-5-磷酸位点重叠,而催化(C)位点与PRPP的焦磷酸位点重叠。[8]特定核苷酸对与两个位点的配对导致协同抑制比加性抑制更强。[8][14][15]抑制通过酶的结构变化发生,其中柔性谷氨酰胺环被锁定在开放位置,从而阻止PRPP的结合。[8]
由于PRA的化学不稳定性,其在pH7.5和37°C下的半衰期为38秒,研究人员提出该化合物是在体内从酰胺基磷酸核糖基转移酶引导至GAR合成酶。[16]
图集
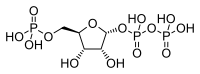
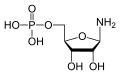 5-磷酸核糖胺
5-磷酸核糖胺
参考文献
- .
- GRCh38: Ensembl release 89: ENSG00000128059 - Ensembl, May 2017
- GRCm38: Ensembl release 89: ENSMUSG00000029246 - Ensembl, May 2017
- . National Center for Biotechnology Information, U.S. National Library of Medicine.
- . National Center for Biotechnology Information, U.S. National Library of Medicine.
- .
- Brayton KA, Chen Z, Zhou G, Nagy PL, Gavalas A, Trent JM, Deaven LL, Dixon JE, Zalkin H. . The Journal of Biological Chemistry. Feb 1994, 269 (7): 5313–21. PMID 8106516. doi:10.1016/S0021-9258(17)37689-5
 .
. - Smith JL. . Current Opinion in Structural Biology. Dec 1998, 8 (6): 686–94. PMID 9914248. doi:10.1016/s0959-440x(98)80087-0.
- Smith JL, Zaluzec EJ, Wery JP, Niu L, Switzer RL, Zalkin H, Satow Y. . Science. Jun 1994, 264 (5164): 1427–1433. Bibcode:1994Sci...264.1427S. PMID 8197456. doi:10.1126/science.8197456.
- . EMBL-EBI. [2022-09-17]. (原始内容存档于2015-04-02).
- Musick WD. . CRC Critical Reviews in Biochemistry. 1981, 11 (1): 1–34. PMID 7030616. doi:10.3109/10409238109108698.
- Kim JH, Krahn JM, Tomchick DR, Smith JL, Zalkin H. . The Journal of Biological Chemistry. Jun 1996, 271 (26): 15549–15557. PMID 8663035. doi:10.1074/jbc.271.26.15549
 .
. - Thoden JB, Holden HM, Wesenberg G, Raushel FM, Rayment I. . Biochemistry. May 1997, 36 (21): 6305–6316. CiteSeerX 10.1.1.512.5333
 . PMID 9174345. doi:10.1021/bi970503q.
. PMID 9174345. doi:10.1021/bi970503q. - Chen S, Tomchick DR, Wolle D, Hu P, Smith JL, Switzer RL, Zalkin H. . Biochemistry. Sep 1997, 36 (35): 10718–10726. PMID 9271502. doi:10.1021/bi9711893.
- Zhou G, Smith JL, Zalkin H. . The Journal of Biological Chemistry. Mar 1994, 269 (9): 6784–6789. PMID 8120039. doi:10.1016/S0021-9258(17)37444-6
 .
. - Antle VD, Liu D, McKellar BR, Caperelli CA, Hua M, Vince R. . The Journal of Biological Chemistry. 1996, 271 (14): 8192–5. PMID 8626510. doi:10.1074/jbc.271.14.8192
 .
.