酶谱法
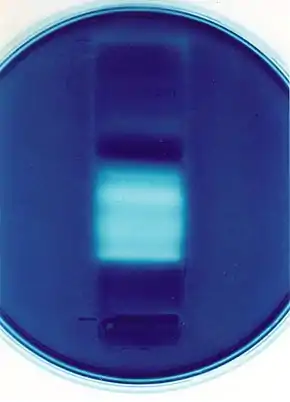
酶谱法或酶谱(英语:Zymography)是一种基于酶的底物库来检测水解酶的凝胶电泳技术。使用三种类型的酶谱法;凝胶酶谱法、原位酶谱法和体内酶谱法中。[2]例如,嵌入聚丙烯酰胺凝胶中的明胶将被凝胶中运行的活性明胶酶消化。考马斯亮蓝染色后,退化区域在深色染色背景下显示为清晰的条带。[3]
酶谱一词的现代用法已经被用来定义发酵产品的研究和编目,例如啤酒或葡萄酒,通常由特定的酿酒师或在确定的发酵类别中进行,例如使用特定的酵母菌株或细菌种类。酶谱也指相关的发酵产品的集合,被视为一个作品集。例如,特定啤酒厂生产的所有啤酒都可以统称为其酶谱。
另见酶学(又称酶谱应用科学)。酶学涉及发酵的生化过程,特别是酿造、酿酒和其他发酵食品中发酵酵母和细菌的选择。例如,啤酒酿造涉及应用顶部(淡啤酒)或底部发酵酵母(啤酒),以生产所需的各种啤酒。酵母的合成会影响啤酒的风味特征,即双乙酰(黄油、奶油糖果的味道或香气)。
凝胶酶谱法
用于SDS-PAGE的样品将在标准非还原加载缓冲液中制备。在这过程中不需要还原剂或将其煮沸,因为它们会干扰酶的重新折叠。在丙烯酰胺凝胶的制备过程中,将合适的底物(例如用于蛋白酶检测的明胶或酪蛋白)包埋在分离胶中。电泳后,通过在未缓冲的曲拉通X-100中孵育从而将凝胶(或酶谱)中的十二烷基硫酸钠去除,然后在适当的消化缓冲液中孵育,以便在37°C下的最佳时间长度孵育。随后对酶谱进行染色(通常使用氨基黑10B或考马斯亮蓝),消化区域显示为清晰的条带,而底物已被酶降解的则呈现深色染色背景。
标准协议的变体
标准方案可能需要根据样品酶进行修改;例如,黑腹果蝇消化糖苷酶通常在还原条件下(即存在2-巯基乙醇或二硫苏糖醇)以及在一定程度上加热条件下存活。事实上,加热到50°C后的分离往往会表现出条带分辨率的显着增加,而没有明显的活性损失。[4][5]
过去用于α-淀粉酶活性酶谱分析的常用方案也就是所谓的W.W.多恩淀粉膜方案。这里运行天然PAGE凝胶以分离匀浆中的蛋白质。随后,将其中溶解(或更准确地说,悬浮)淀粉的薄凝胶覆盖在原始凝胶上一段时间。[6]然后用卢戈氏碘液对淀粉染色。
凝胶酶谱通常用于检测和分析微生物产生的酶。[7]这导致了标准协议的变化,例如混合底物酶谱法。[8]
反向酶谱将底物和酶与丙烯酰胺共聚,可用于证明酶抑制剂的活性。染色后,抑制区域可视化为透明(或轻微染色)背景下的暗条带。
参见
参考资料
- Hempelmann, E.; Putfarken, B.; Rangachari, K.; Wilson, R.J.M. . Parasitology. 1986, 92 (2): 305–312. PMID 3520446. doi:10.1017/S0031182000064076.
- Vandooren J, Geurts N, Martens E, Van den Steen PE, Opdenakker G. . Nat Methods. 2013, 10 (3): 211–220. PMID 23443633. S2CID 5314901. doi:10.1038/nmeth.2371.
- . www.abcam.com. [2017-05-12]. (原始内容存档于2023-02-22) (英语).
- Martínez TF, Alarcón FJ, Díaz-López M, Moyano FJ. . Electrophoresis. 2000, 21 (14): 2940–2943. PMID 11001307. doi:10.1002/1522-2683(20000801)21:14<2940::AID-ELPS2940>3.0.CO;2-S.
- Snoek-van Beurden PA, Von den Hoff JW. . BioTechniques. 2005, 38 (1): 73–83. PMID 15679089. doi:10.2144/05381RV01
 .
. - Doane WW. . J Exp Zool. 1969, 171 (3): 31–41. PMID 5348624. doi:10.1002/jez.1401710308.
- Lantz MS, Ciborowski P.
 . Methods Enzymol. Methods in Enzymology. 1994, 235: 563–594. ISBN 9780121821364. PMID 8057927. doi:10.1016/0076-6879(94)35171-6.
. Methods Enzymol. Methods in Enzymology. 1994, 235: 563–594. ISBN 9780121821364. PMID 8057927. doi:10.1016/0076-6879(94)35171-6.