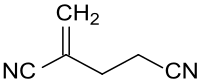
2-亚甲基戊二腈
2-亚甲基戊二腈(英語:,MGN)是丙烯腈的二聚体,也是一种重要的有机合成中间体,化学式为C6H6N2。2-亚甲基戊二腈是二胺和多胺的起始原料,如杀生物剂溴菌腈;亦可闭环合成杂环化合物,如3-氰基吡啶。
| 2-亚甲基戊二腈 | |
|---|---|
 | |
| IUPAC名 2-Methylidenepentanedinitrile | |
| 英文名 | |
| 别名 | 2,4-二氰基-1-丁烯 |
| 识别 | |
| CAS号 | 1572-52-7 |
| PubChem | 74080 |
| ChemSpider | 66697 |
| SMILES |
|
| InChI |
|
| InChIKey | NGCJVMZXRCLPRQ-UHFFFAOYSA-N |
| 性质 | |
| 化学式 | C6H6N2 |
| 106.13 g·mol⁻¹ | |
| 外观 | 透明无色[1] 液体 |
| 密度 | 0.976 g·cm−3 (25 °C)[2] |
| 危险性 | |
GHS危险性符号 | |
| GHS提示词 | Warning |
| H-术语 | H302, H312, H332 |
| P-术语 | P261, P264, P270, P271, P280, P301+312, P302+352, P304+312, P304+340, P312, P322, P330, P363, P501 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
制备
2-亚甲基戊二腈是生产己二腈的副产物,己二腈(氢化为1,6-二氨基己烷后)是合成工程塑料(如聚酰胺PA66或聚氨酯)的关键原料。己二腈在工业上通过丙烯腈的电化学法加氢二聚或催化二聚生产。
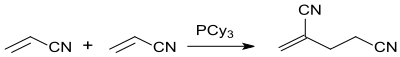
两分子的丙烯腈“尾对尾”地二聚成己二腈:
在该过程中也会发生“头对尾”的二聚反应,在催化剂如P(Cy)3作用下,2-亚甲基戊二腈的产率可达77%[3]:
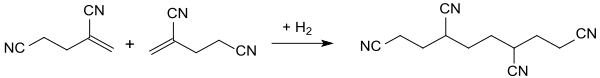
许多文献报道了金属卤盐(如氯化锌 [4][5]和氯化铝 [6])和叔胺(如三乙胺)作催化剂的二聚方法,粗产率可达84%[4](此类方法合成的产物通常有纯化困难的问题)。介于2-亚甲基戊二腈有聚合的倾向,在后续加工过程中(如萃取或蒸馏)通常会损失大量的产物。
除线性二聚体外,通常也会产生其他的丙烯腈低聚物。在电化学法加氢低聚过程中,会产生三聚体如1,3,6-和1,3,5-三氰基己烷,或四聚体如1,3,6,8-和1,3,5,8-四氰基辛烷[7]。 单一催化剂的丙烯腈二聚反应通常产率较低,例如丙烯腈与三丁基膦的产物分馏后得到的2-亚甲基戊二腈产率较低,约为10%[8]。DABCO催化的丙烯腈二聚反应,在室温下反应10天后的产率约为40%,同样低效[9]。
用途
早期的文献中存在利用2-亚甲基戊二腈异构化为1,4-二氰基-2-丁烯,并以此作为己二腈合成前体的用途,但随着丙烯腈的电化学法加氢二聚反应的不断优化,此类用途已经过时[10]。 2-亚甲基戊二腈同样可以电化学加氢二聚化,产生1,3,6,8-四氰基辛烷[8]。
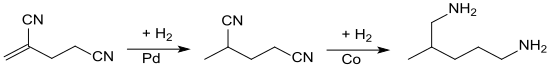
在钯碳催化下,可以选择性地为碳碳双键加氢,得到2-甲基戊二腈 [11]。 在氰基上加氢更困难,并需要氨或胺的存在以抑制仲胺的形成。第二步氢化通过雷尼钴催化发生,产物2-甲基-1,5-戊二胺的产率为80%[12]。
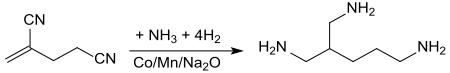
在氨存在时,用掺杂锰、氧化钠的钴催化剂(管式反应器,80-100 ℃,200 atm)可以将氨加成至双键上,产物2-氨基甲基-1,5-戊二胺,产率为66%[13]。
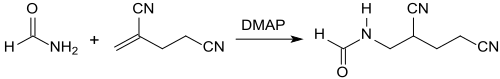
2-甲基戊二腈在4-二甲氨基吡啶(DMAP)催化下,于60 ℃与甲酰胺加氢得到1-(N-甲酰氨基)-2,4-二氰基丁烷,并能水解得到α-氨基甲基戊二酸[14]。
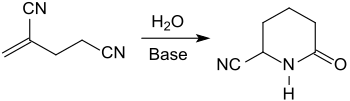
2-亚甲基戊二腈与碱性离子交换器 、吡啶和水,在高压釜中加热至150 ℃,能得到内酰胺6-氰基哌啶-2-酮,产率为80%[15]。
2-亚甲基戊二腈可以通过与氰化钠、液氨中的钠或丁基锂等发生阴离子加成聚合反应而形成均聚物和共聚物。这些聚合物的产率较低,并表现出不佳的特性,如特性粘度和机械性能[16]。
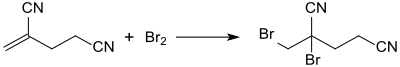
2-亚甲基戊二腈的主要用途是作为有机合成的起始原料,如广谱杀生物剂溴菌腈2-溴-2-溴甲基戊二腈[17][18]:
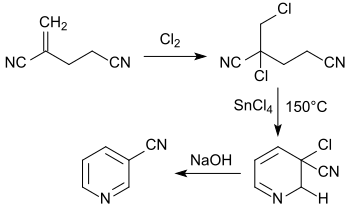
类似的2-氯-2-氯甲基戊二腈,使用氯化锡加热至150 ℃后可以得到3-氰基吡啶 [17]。
参考文献
- . www.tcichemicals.com. [2018-01-14]. (原始内容存档于2018-01-15) (英语).
- 来源:Sigma-Aldrich Co., product no. 125547 .
- L. Yu; et al, , RSC Adv. 4, 2014, 4: 19122–19126, doi:10.1039/C4RA02810D
- US 3733351,Y. Watanabe, M. Takeda,「Production of 2-methylene-glutaronitrile」,发表于1973-05-15
- US 4422981,H. Omori, M. Takeda, K. Fujita, M. Kataoka,「Process for production of 2-methyleneglutaronitrile」,发表于1983-12-27
- US 3956358,O.T. Onsager,「Dimerization method」,发表于1976-05-11
- M.M. Baizer; J.D. Anderson, , J. Org. Chem. 30 (5), 1965, 30 (5): 1351–1356, doi:10.1021/jo01016a003
- M.M. Baizer; J.D. Anderson, , J. Org. Chem. 30 (5), 1965, 30 (5): 1357–1360, doi:10.1021/jo01016a004
- D. Basavaiah; V.V.L. Gowriswari; T.K. Barathi, , Tetrahedron Lett. 28 (39), 1987, 28 (39): 4591–4592, doi:10.1016/S0040-4039(00)96573-0
- US 3795694,O.T. Onsager,「Preparation of cyano compounds」,发表于1974-03-05
- US 3350439,J. Feldman, M. Thomas,「Process for preparing aminoalkanenitriles」,发表于1967-10-31
- US 3408397,J. Feldman, M. Thomas,「Methyl pentamethylene diamine process」,发表于1967-10-31
- EP 1028104,K. Fischer, F. Richter, A. Bazanov, A. Timofeev, N. Zubritskaya, G. Smirnova,「Verfahren zur Herstellung von 2-Aminomethyl-1,5-pentandiamin」,发表于2000-08-16
- EP 0336185,H.-J. Scholl,「1-(N-Formylamino)-2,4-dicyanobutan und ein Verfahren zu dessen Herstellung」,发表于1989-10-11
- US 3666766,J.B. Pedigo, J. Feldman, I.A. Kereszies,「Selective hydrolysis and cyclization of unsaturated nitriles」,发表于1972-05-30
- US 3451977,J.M. Hoyt, K. Koch,「Process for polymerizing 2-methylene glutaronitrile」,发表于1969-06-24
- US 3644380,R. Harmetz, R.J. Tull,「Preparation of 3-cyanopyridine」,发表于1972-02-22
- US 3929858,R.D. Swigert,「Method for preparing 2-bromo-2-bromomethyl-glutaronitrile」,发表于1975-12-30