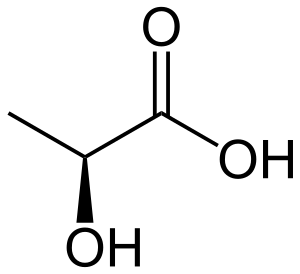
乳酸
乳酸(IUPAC學名:2-羥基丙酸)是一种化合物,它在多种生物化学过程中起作用。它是一种羧酸,分子式是C3H6O3。它是一个含有羟基的羧酸,因此是一个α-羟酸(AHA)。在水溶液中它的羧基释放出一个质子,而产生乳酸根离子 - 乳酸質(Lactate) - CH3CHOHCOO−。
| 2-羥基丙酸 | |||
|---|---|---|---|
| |||
 | |||
| IUPAC名 2-羥基丙酸 2-Hydroxypropanoic acid | |||
| 别名 | 乳酸 | ||
| 识别 | |||
| CAS号 | 50-21-5 79-33-4(L) 10326-41-7(D) | ||
| ChemSpider | 96860 | ||
| SMILES |
| ||
| ChEBI | 422 | ||
| 性质 | |||
| 化学式 | C3H6O3 | ||
| 摩尔质量 | 90.08 g·mol−1 | ||
| 熔点 | L: 53 °C D: 53 °C D/L: 16.8 °C | ||
| 沸点 | 122 °C at 12 mmHg | ||
| pKa | 3.86[1] | ||
| 热力学 | |||
| ΔcHm⦵ | 1361.9 kJ/mol, 325.5 kcal/mol, 15.1 kJ/g, 3.61 kcal/g | ||
| 相关物质 | |||
| 相关羧酸 | 乙酸 乙醇酸 丙酸 丙二酸 丁酸 | ||
| 相关化学品 | 1-丙醇 2-丙醇 丙醛 丙烯醛 乳酸鈉 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
乳酸有手性,有两个旋光异构体。一个被称为L-(+)-乳酸或(S)-乳酸,另一个被称为D-(-)-乳酸或(R)-乳酸。L-(+)-是在生物学上重要的异构体。
历史
1780年卡尔·威廉·舍勒在中发现了乳酸。1808年贝采利乌斯发现了肌肉内的乳酸,1873年约翰内斯·威利森努斯澄清了其结构。1895年勃林格殷格翰公司发明了使用细菌制造乳酸的方法,从而开始了工业化的生物制造技术。
生物学
在发酵过程中乳酸脱氢酶将丙酮酸转换为左旋乳酸。在一般的新陈代谢和运动中乳酸不断被产生,但是其浓度一般不会上升。只有在乳酸产生过程加快,乳酸无法被及时运走时其浓度才会提高。乳酸运输速度由一系列因素影响,其中包括单羧基转运体、乳酸脱氢酶的浓度和异构体形式、组织的氧化能力。一般来说血液中的乳酸浓度在不运动时为1-2 mmol/L,在强烈运动时可以上升到20mmol/L。
一般来说当组织的能量无法通过有氧呼吸得以满足,组织无法获得足够的氧或者无法足够快地处理氧的情况下乳酸的浓度会上升。在这种情况下丙酮酸脱氢酶无法及时将丙酮酸转换为乙酰辅酶A,丙酮酸开始堆积。在这种情况下假如乳酸脱氢酶不将丙酮酸还原为乳酸的话,糖酵解过程和三磷酸腺苷的生产会获得抑制。产生乳酸的过程为:
- 丙酮酸 + NADH + H+ → 乳酸 + NAD+
这个过程的意义在于重建糖酵解所需要的烟酰腺嘌呤二核苷酸(NAD+)来保持三磷酸腺苷的生产。
在氧气充足的肌肉细胞中乳酸可以被氧化为丙酮酸,然后直接用来作为三羧酸循环的燃料。它也可以在肝脏内糖异生的过程中通过科里循环转化为葡萄糖。
乳杆菌属的细菌也可以进行乳酸发酵。这些细菌可以生活在口内,它们产生的乳酸是导致齲齒的原因。
在医学裡乳酸常被用在乳酸林格氏液中。这是一种与人的血液等张的氯化钠、氯化钾和乳酸在蒸馏水中的溶液。在损伤、手术或烧伤失血后常使用乳酸林格氏液来补充失血。
运动
在强烈运动的过程中人体需要大量能量。这时人体内乳酸質的生产比组织移走乳酸质的速度高,组织内的乳酸质浓度提高。这个过程保障NAD+的再生和运动的继续。不像一般错误的描述,乳酸质浓度的上升本身并不导致酸中毒,它也不是肌肉酸痛的原因。在人体内乳酸质无法释放质子,因此没有酸性。对人体内糖酵解途径的分析证明这个过程不会导致酸中毒。
强烈运动时造成的酸中毒有另一个原因。在三磷酸腺苷被分裂释放能量時它释放一个质子,这些质子是导致酸中毒的原因。在强烈运动时有氧新陈代谢(Aerobic Metabolism)无法保障三磷酸腺苷的生产,因此无氧新陈代谢(Anaerobic Metabolism)开始。这个过程可以产生大量三磷酸腺苷,这些三磷酸腺苷在分解时释放大量质子,降低组织内的pH值,造成酸中毒。这也许是强烈运动过程中肌肉酸痛的众多原因之一。
包裝工業
乳酸為製造聚乳酸(Poly lactic acid)的單體,聚乳酸目前被廣泛地應用,由於其具有生物可分解性質。
參考資料
- Dawson, R. M. C. et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.