布鲁克重排反应
布鲁克重排反应早期是指碱作用下硅基从碳原子向氧原子的阴离子型-迁移反应,目前已拓展至所有-碳向氧的硅基迁移反应,现在已发展至-迁移反应。反应是从羟基硅烷到硅醚的转化。[1]

反应得名於加拿大化学家阿德里安·吉布斯·布鲁克。
硅原子上的取代基可以是脂肪基团或芳香基团,醇可以是仲醇或叔醇;脂肪醇或芳香醇。常用的碱有胺类、氢氧化钠、有机锂试剂或碱金属合金如钠钾合金。
布鲁克重排反应的相反过程,硅基从氧到碳上的分子内迁移反应也可以发生,称为逆布鲁克重排反应。[2]
反应机理
布鲁克重排反应及逆布鲁克重排反应均经过同样的硅负离子中间体。
反应机理中,首先是碱夺取羟基氢,生成烷氧负离子,然后烷氧负离子作为亲核试剂进攻硅原子,经过环状的硅负离子过渡态(对于 -迁移来说是三元环),负电荷转移到碳原子上,Si-C 键断裂生成碳负离子,最后碳负离子从质子供体夺取一个质子生成产物硅基醚。
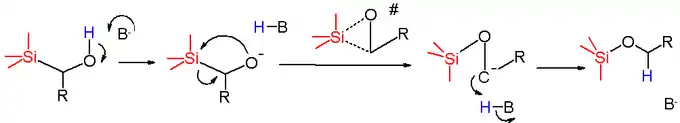
由于反应中间体为有用的碳负离子,因此可发生进一步的串联反应。[5] 这一策略作为高效的方法学,正在天然产物合成中获得日渐广泛的应用。
底物为(三苯硅基)甲基苯基原醇时,研究发现反应的活化能并不很高,但活化熵却是十分小的负值,从而证实了反应中环状过渡态的存在。另外,通过研究对位取代基不同的苯基原醇发生反应的哈米特方程结果,也可以证实吸电子基团对反应中碳负离子中间体的稳定作用。
布鲁克重排反应的推动力是产物中键能较高的Si-O键的生成。
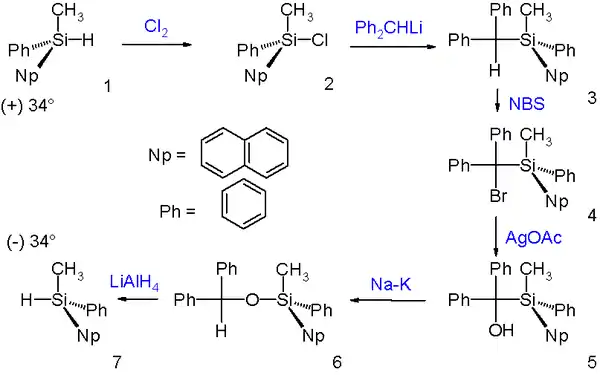
布鲁克重排反应后得到构型保持的产物。下图中的例子就利用了这个性质,使烃基取代硅烷的(+)-对映体在经过一系列反应后转变为对应的(−)-异构体。首先它被氯气氯化为氯硅烷,氯硅烷与二苯甲基锂发生亲核取代作用,伴随构型翻转。然后为了除去二苯甲基,作者首先用N-溴代丁二酰亚胺(NBS)将其溴化,接着用乙酸银处理得到醇,然后使其在钠钾合金作用下发生布鲁克重排反应,生成二苯甲氧基取代的衍生物,并用氢化铝锂将Si-O键切断,最终得到需要的(−)-烃基硅烷异构体。
参考资料
- A. G. Brook. . Acc. Chem. Res. 1974, 7 (3): 77–84. doi:10.1021/ar50075a003.
- William F. Bailey and Xinglong Jiang. (PDF). Arkivoc. 2005: 25–32.
- Patrocinio, Amauri F. and Moran, Paulo J. S. . J. Braz. Chem. Soc. 2001, 12 (1): 7–31 [2009-09-19]. (原始内容存档于2007-09-29).. ISSN 0103-5053.
- Philip C. Bulman Page, Monique B. van Niel and Donald Westwood. . J. Chem. Soc., Perkin Trans. 1. 1988, (2): 269–275. doi:10.1039/P19880000269.
- Amos B. Smith, III, Ming Xian, Won-Suk Kim and Dae-Shik Kim. . J. Am. Chem. Soc. 2006, 128 (38): 12368–12369. doi:10.1021/ja065033e.